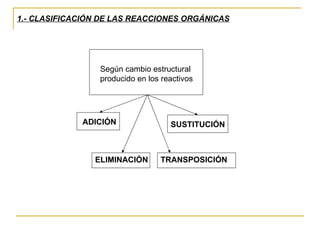
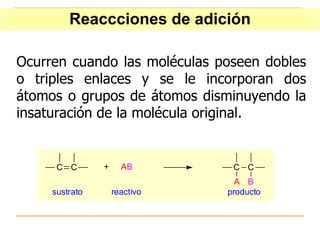
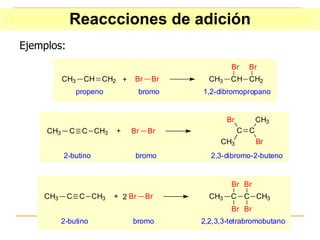
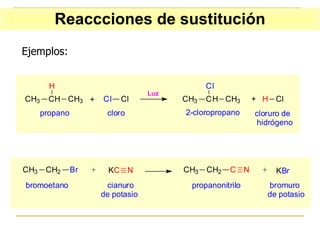
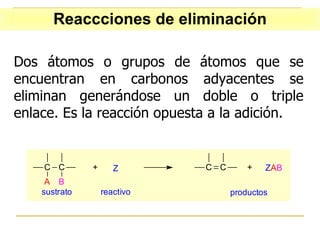
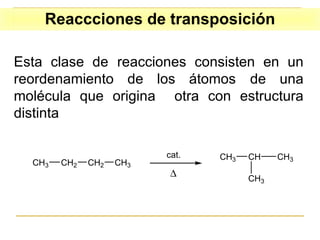
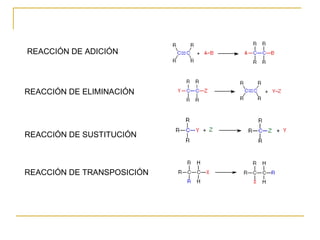
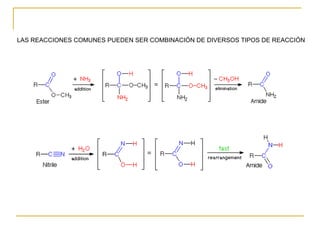
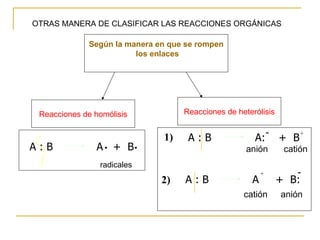
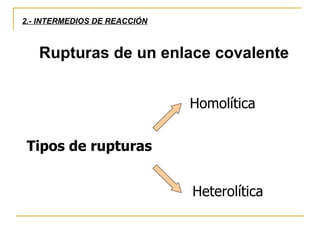
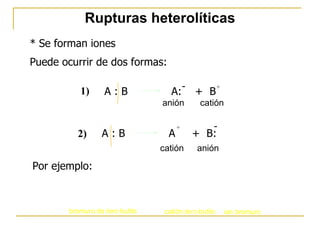
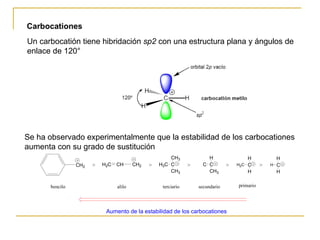
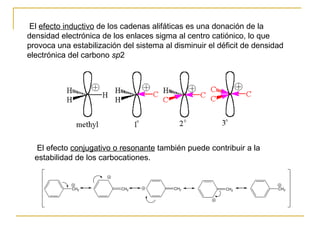
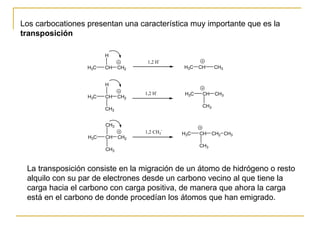
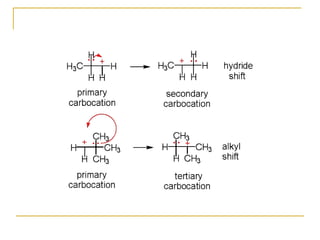
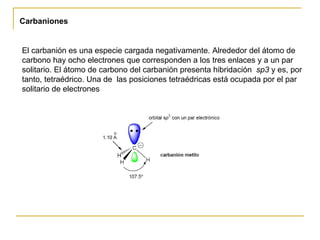
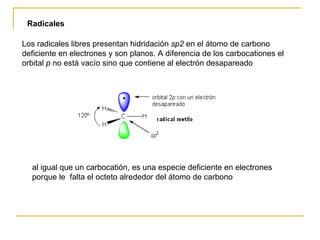
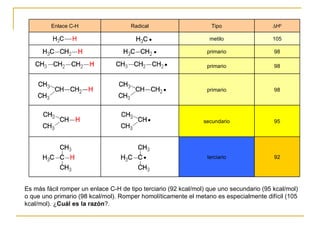
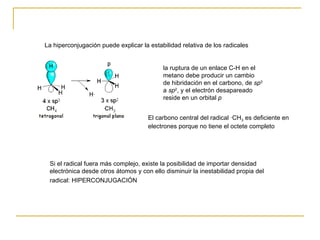
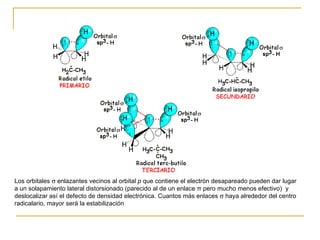
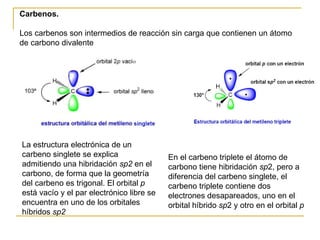
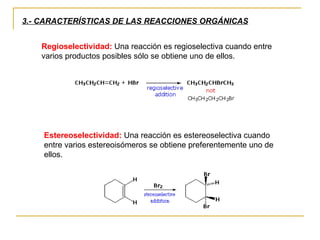
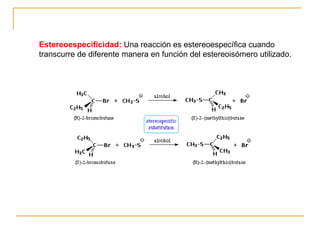
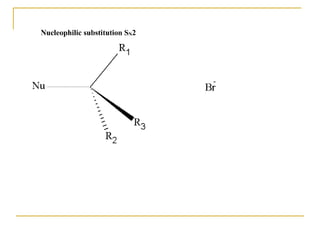
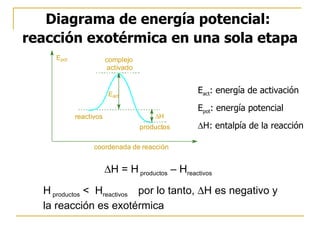
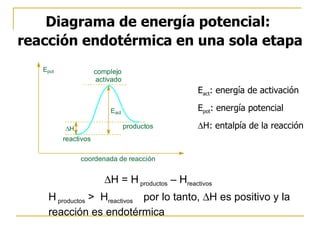
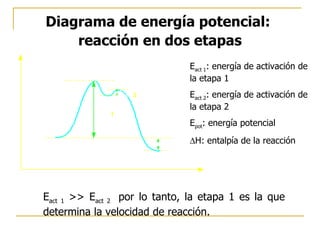
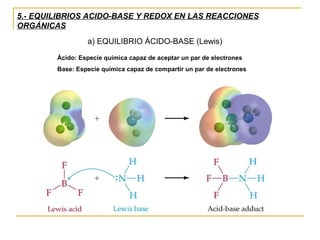
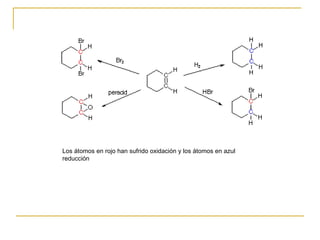
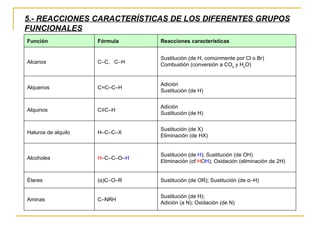
El documento clasifica y describe diferentes tipos de reacciones orgánicas, incluyendo reacciones de adición, eliminación, sustitución y transposición. También describe intermedios de reacción como carbocationes, carbaniones y radicales libres. Finalmente, discute características como la regioselectividad y estereoselectividad de las reacciones orgánicas.