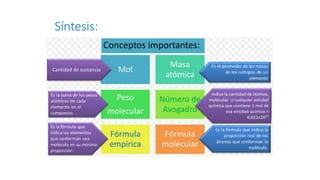
Este documento introduce las unidades químicas de masa como el átomo-grama, molécula-grama, mol y número de Avogadro. Explica cómo calcular la masa atómica promedio, masa molecular, composición porcentual y cómo interpretar una fórmula química. Incluye ejemplos de cálculos de masas atómicas, molares, números de átomos y moléculas, y composiciones porcentuales.