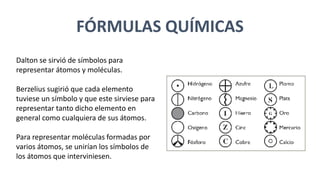
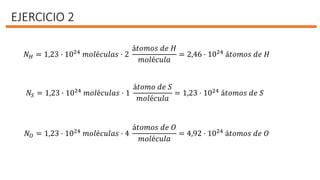
El documento describe la historia del desarrollo de las fórmulas químicas, incluyendo los símbolos introducidos por Dalton y Berzelius para representar átomos y moléculas, y cómo estas fórmulas representan los elementos que componen una sustancia y la relación entre los átomos. También presenta ejercicios de cálculo de masas moleculares, cantidad de mol y número de partículas para diferentes compuestos químicos.