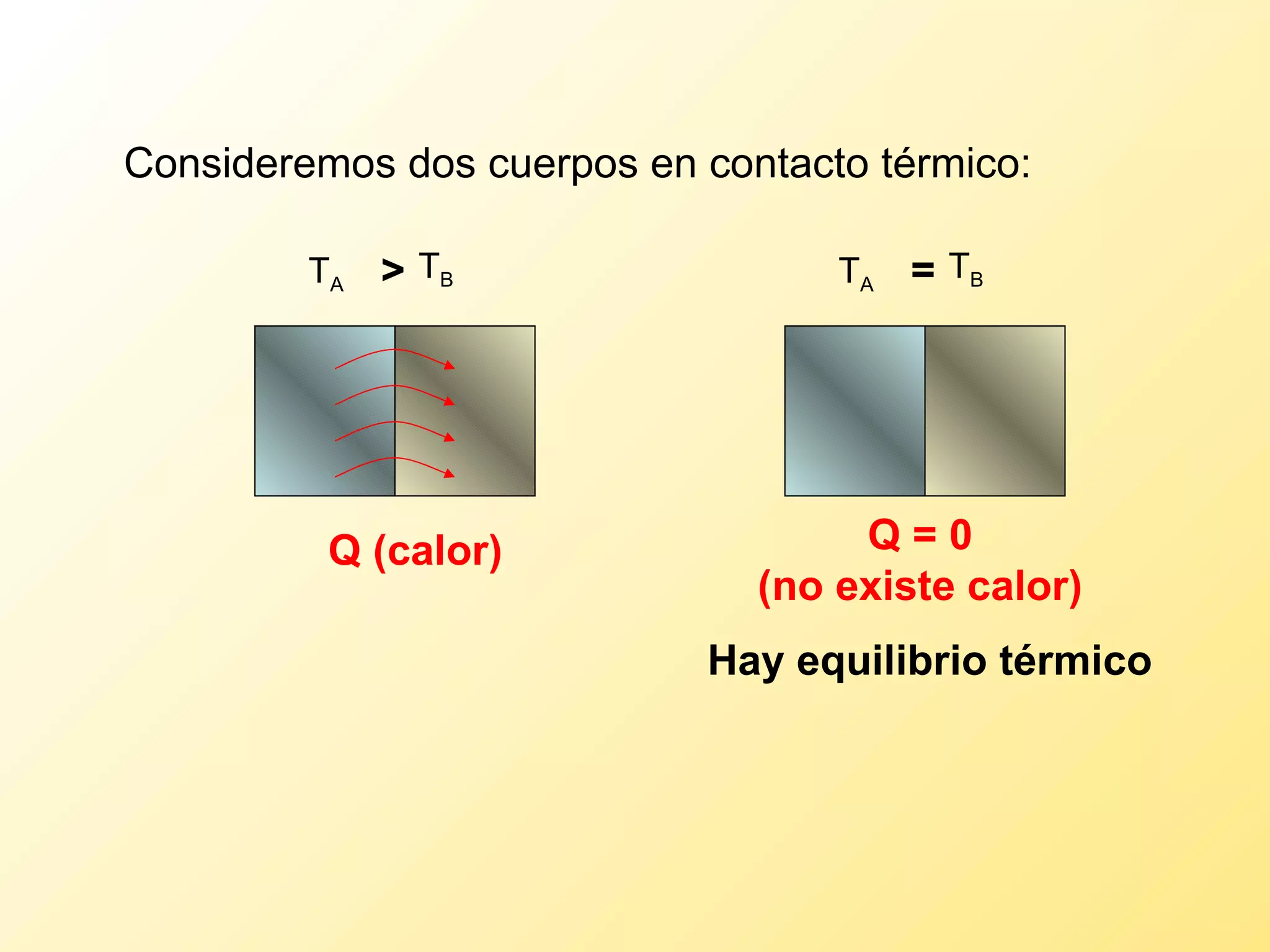
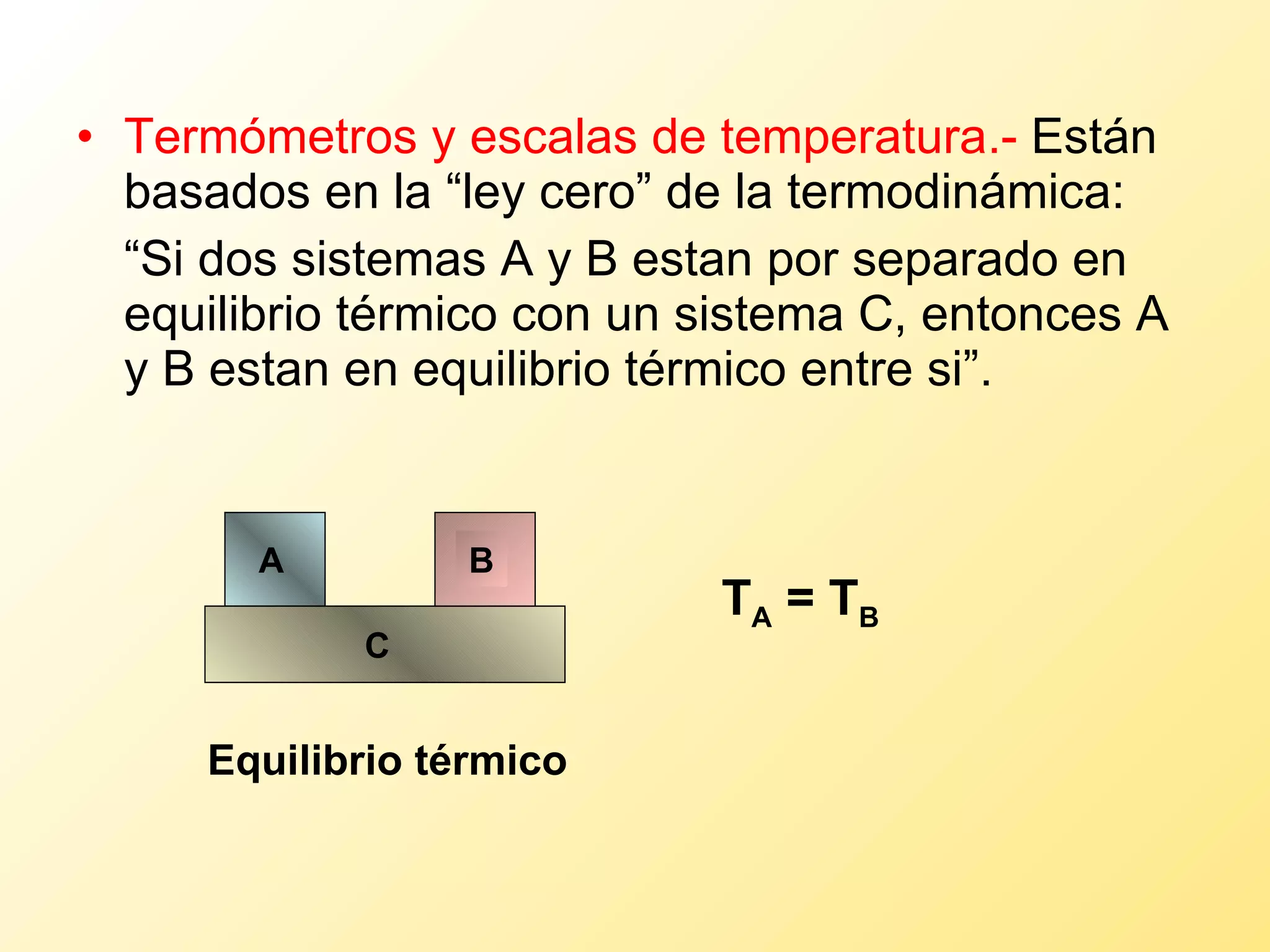
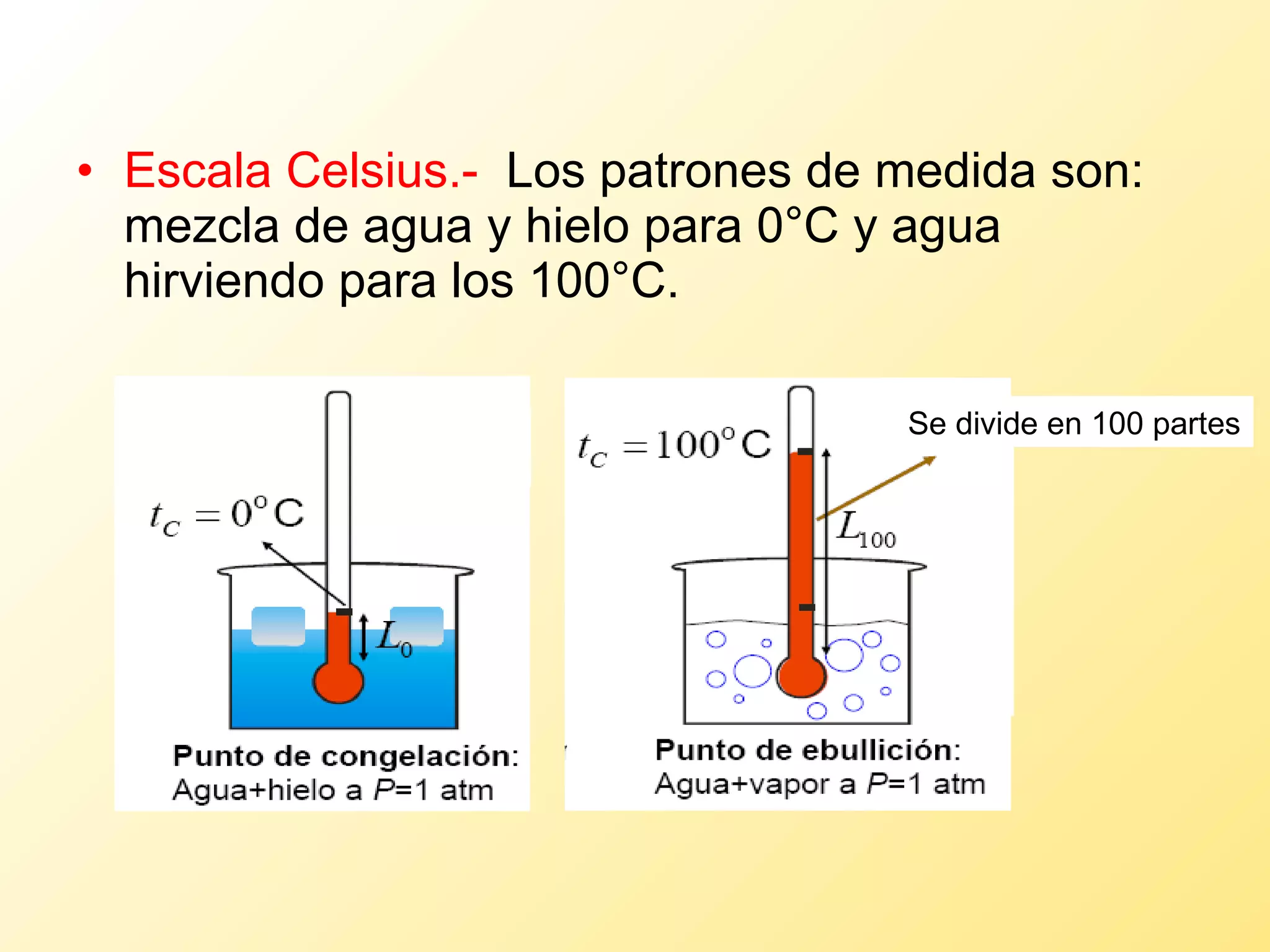
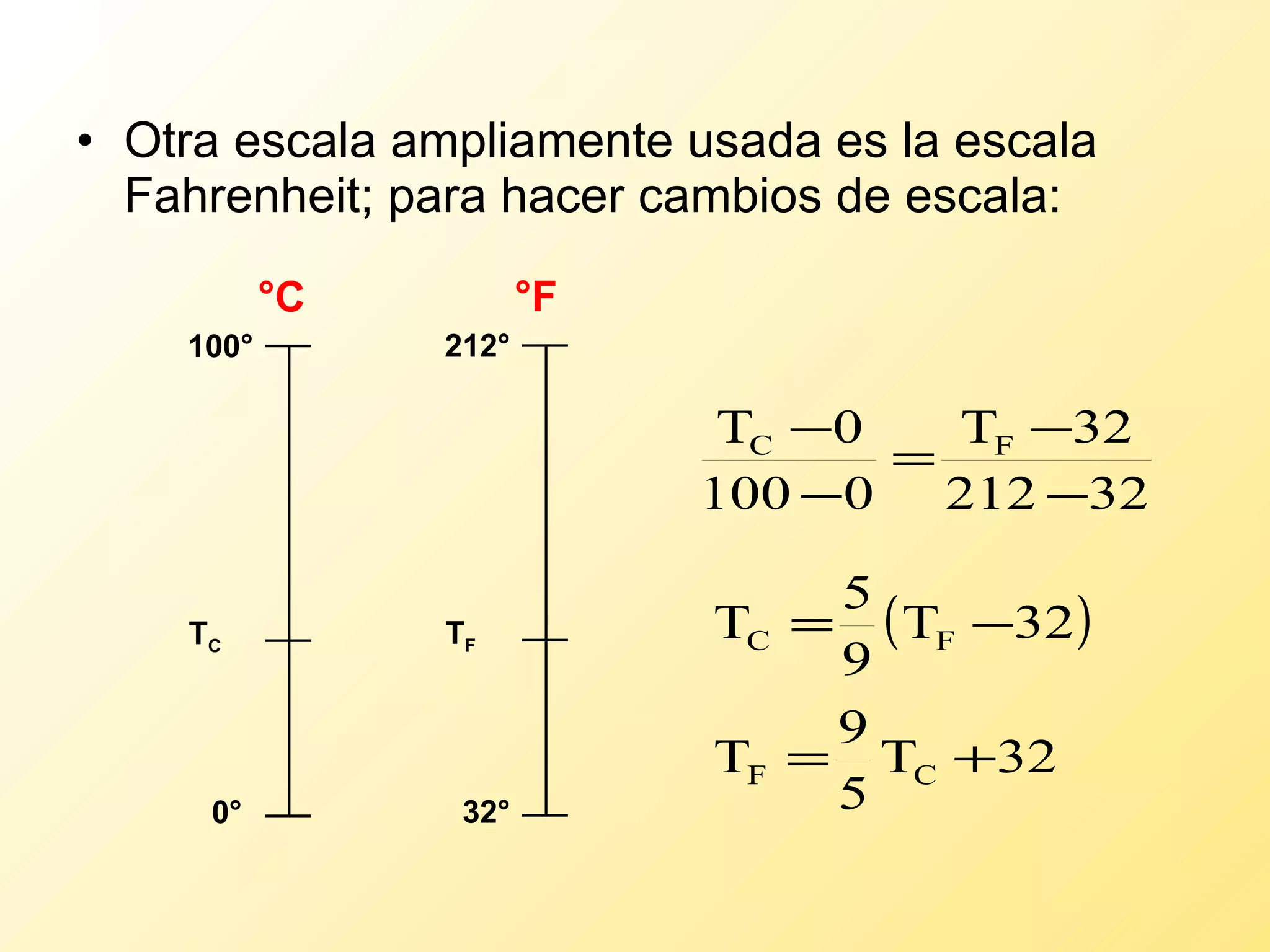
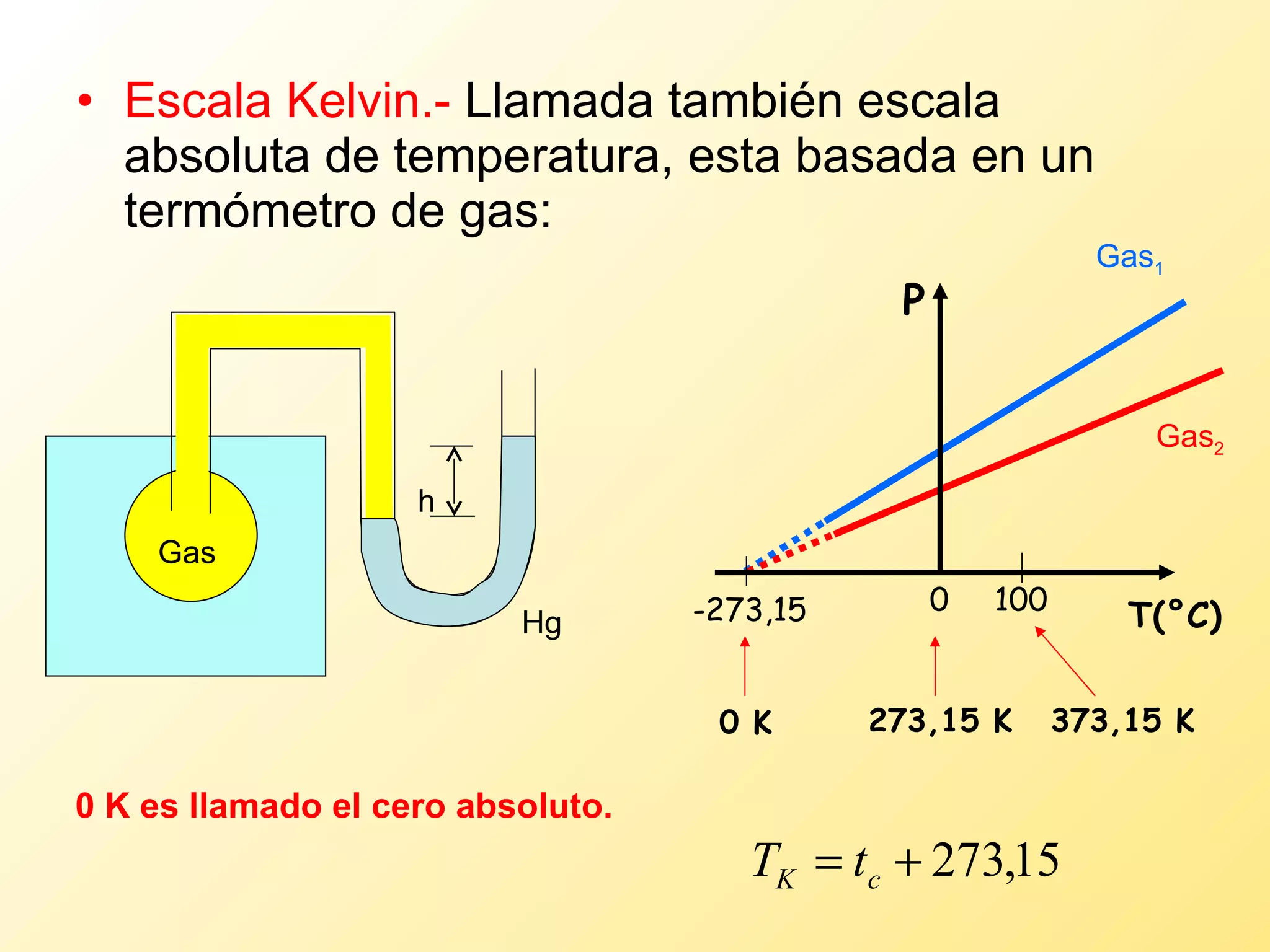
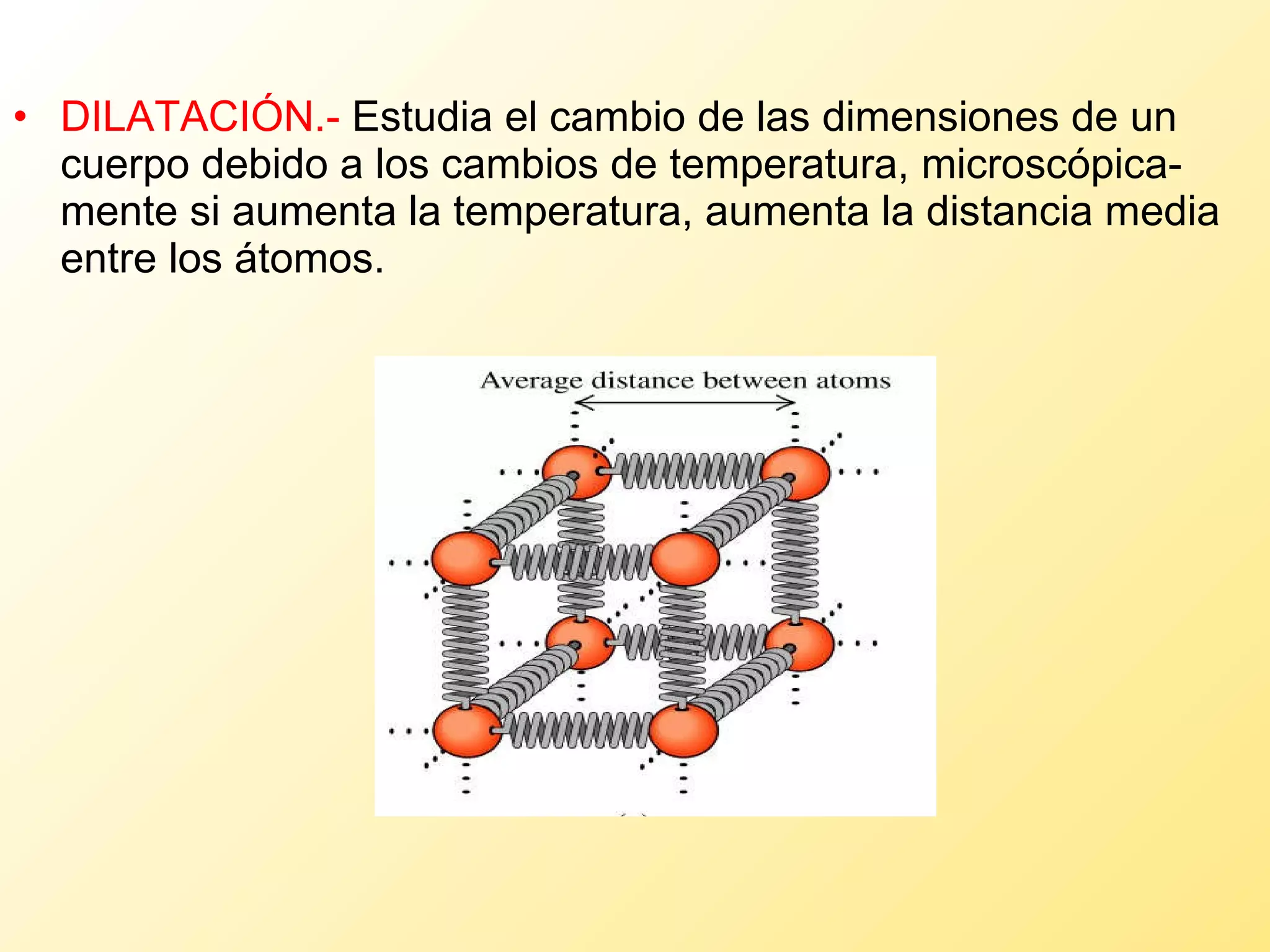
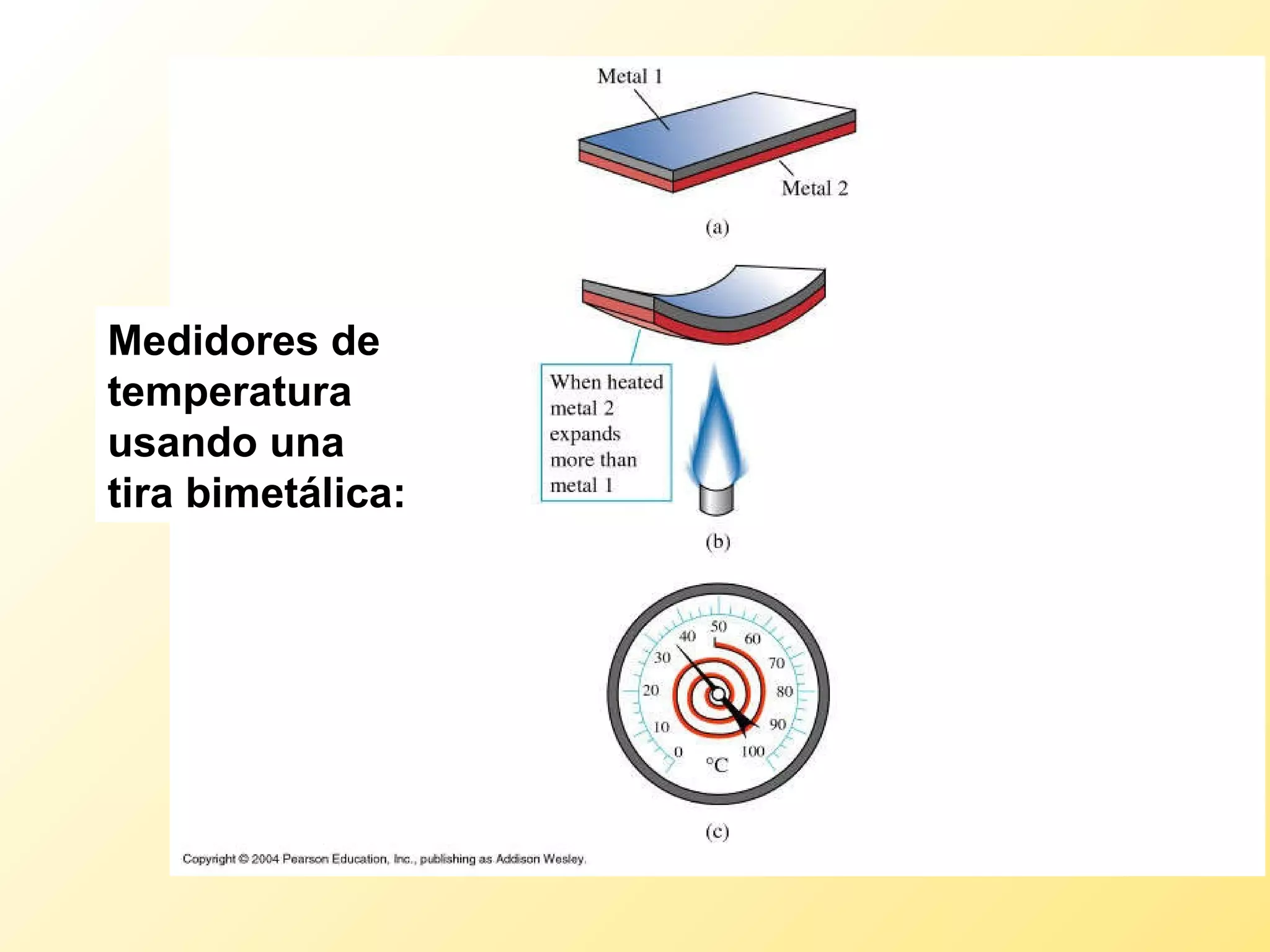
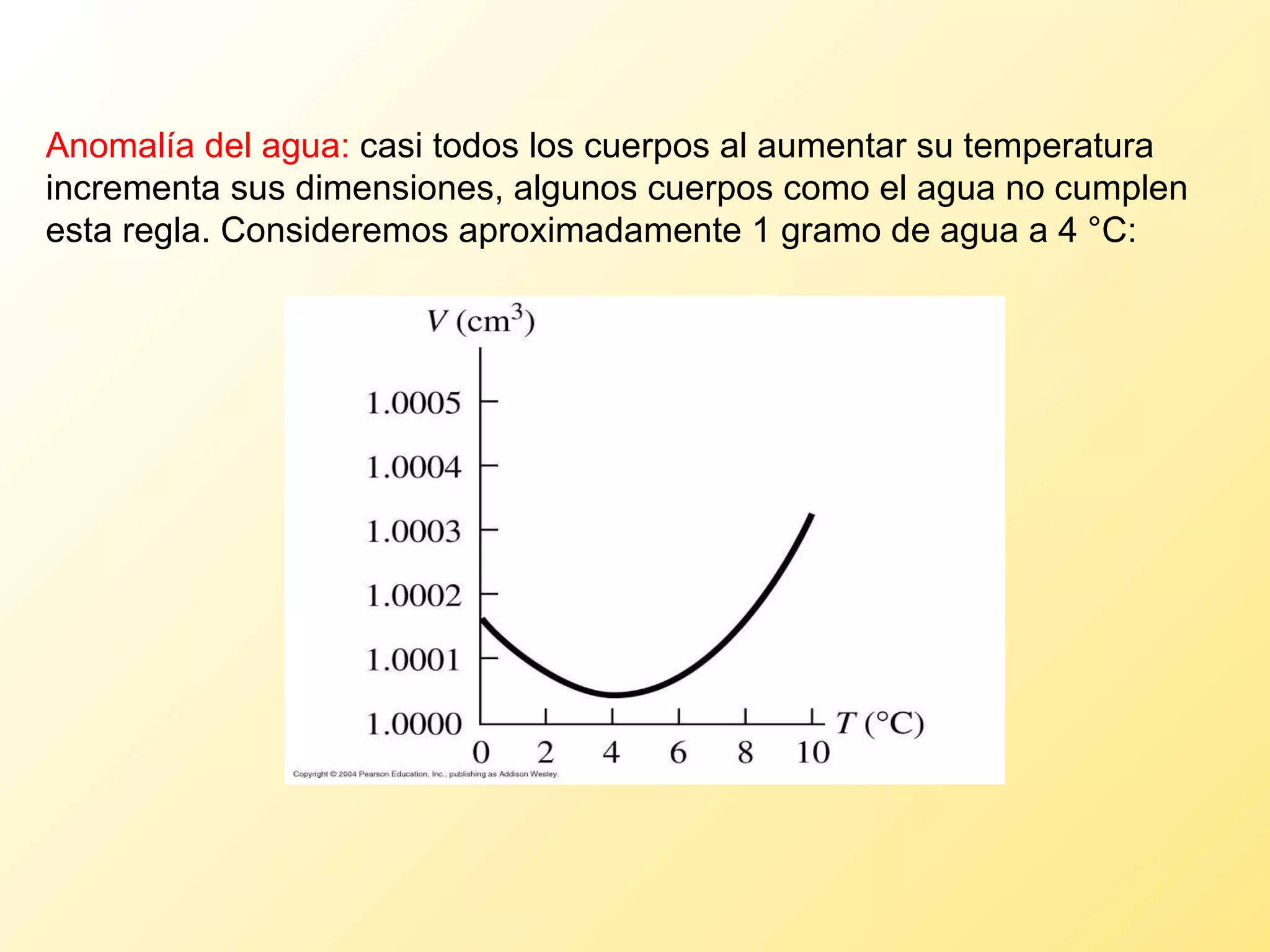
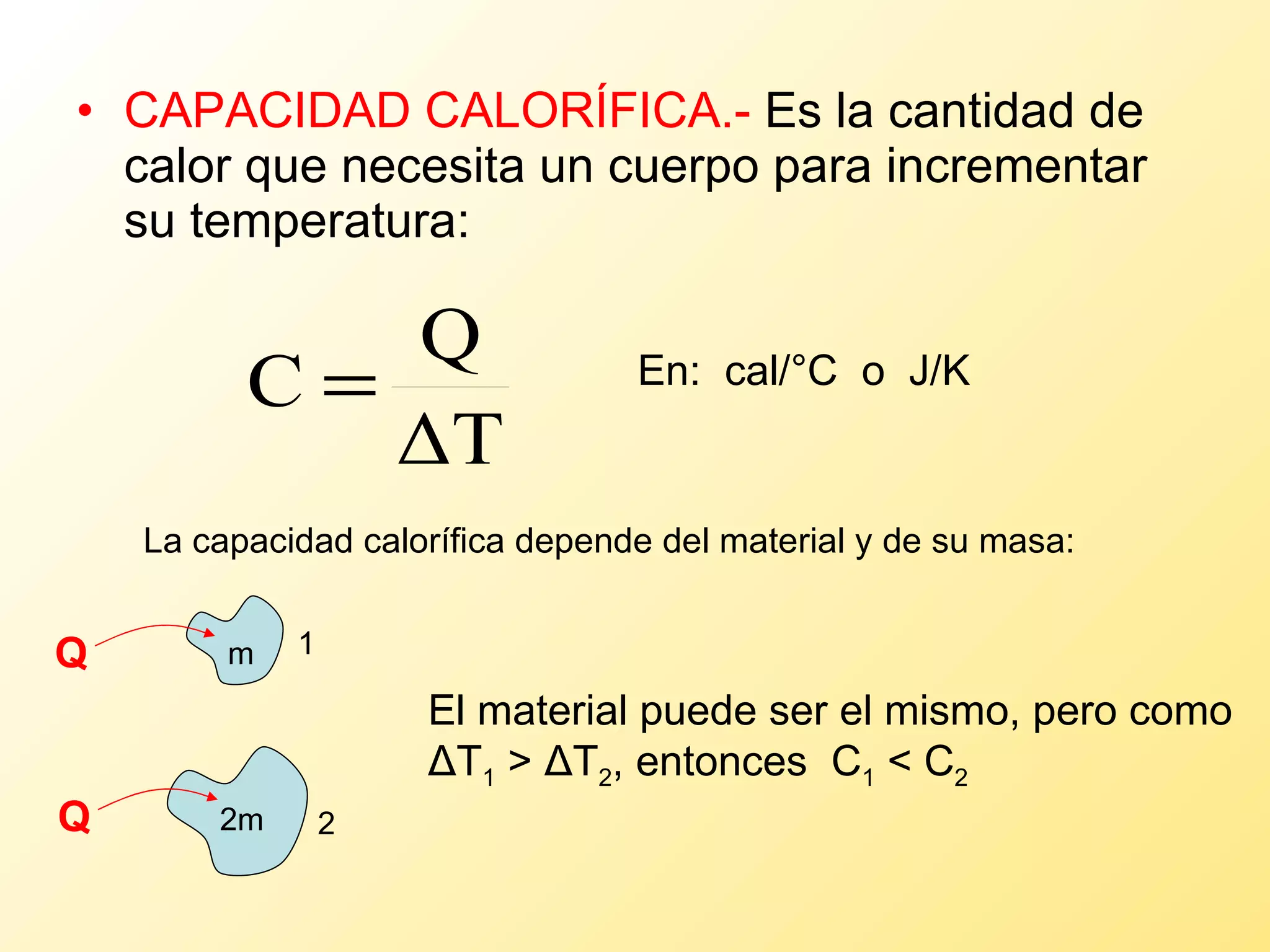
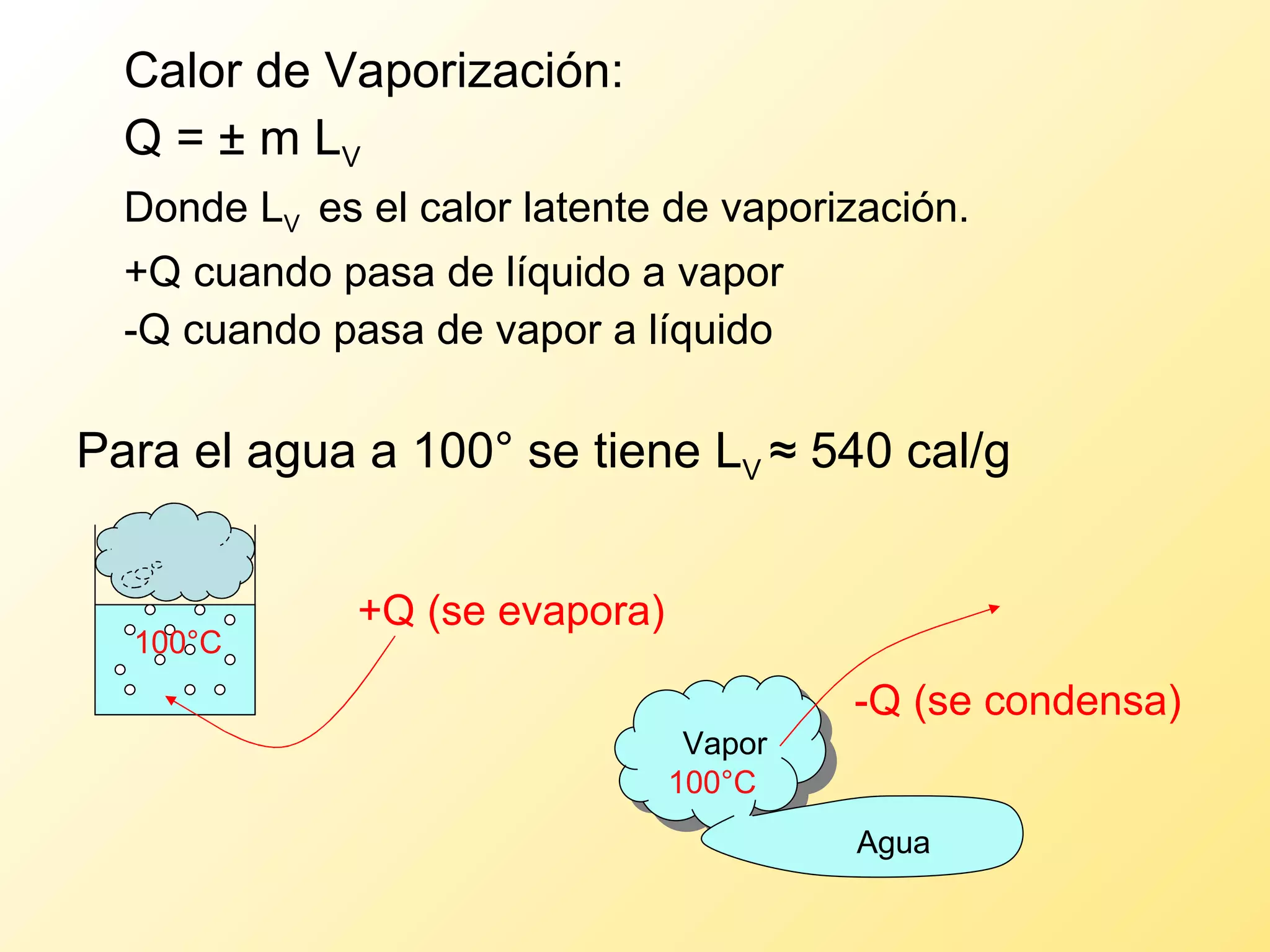
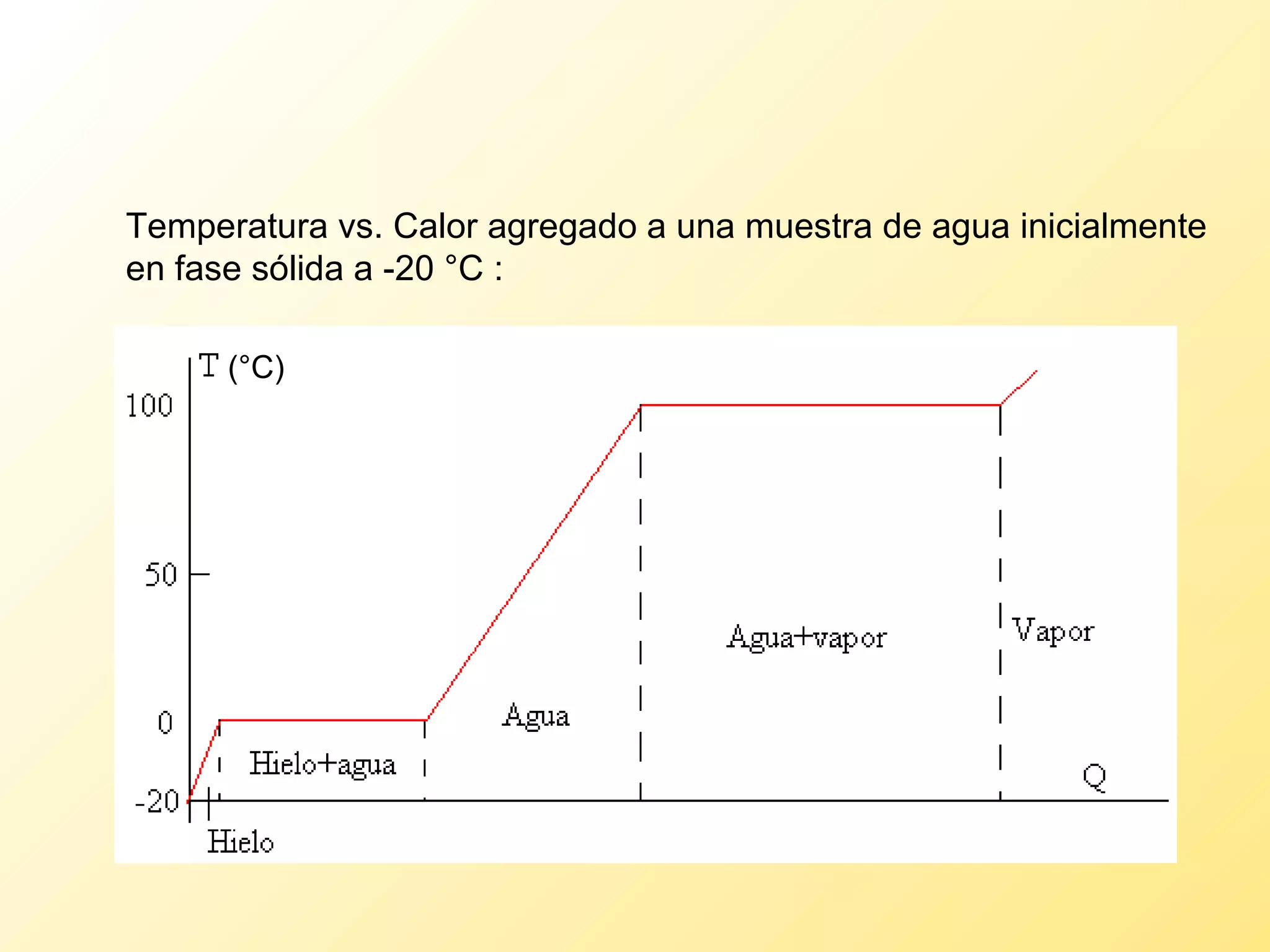
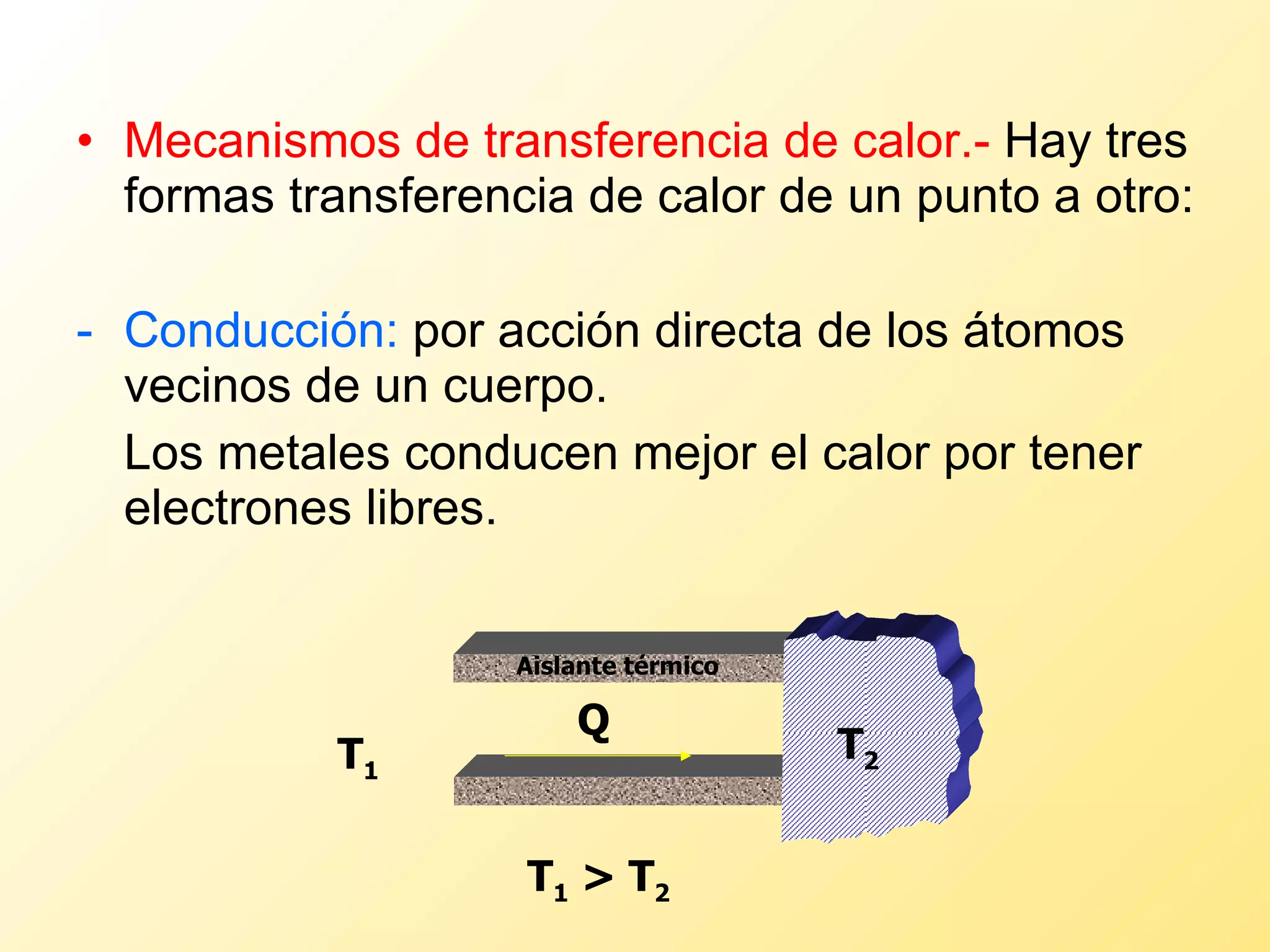
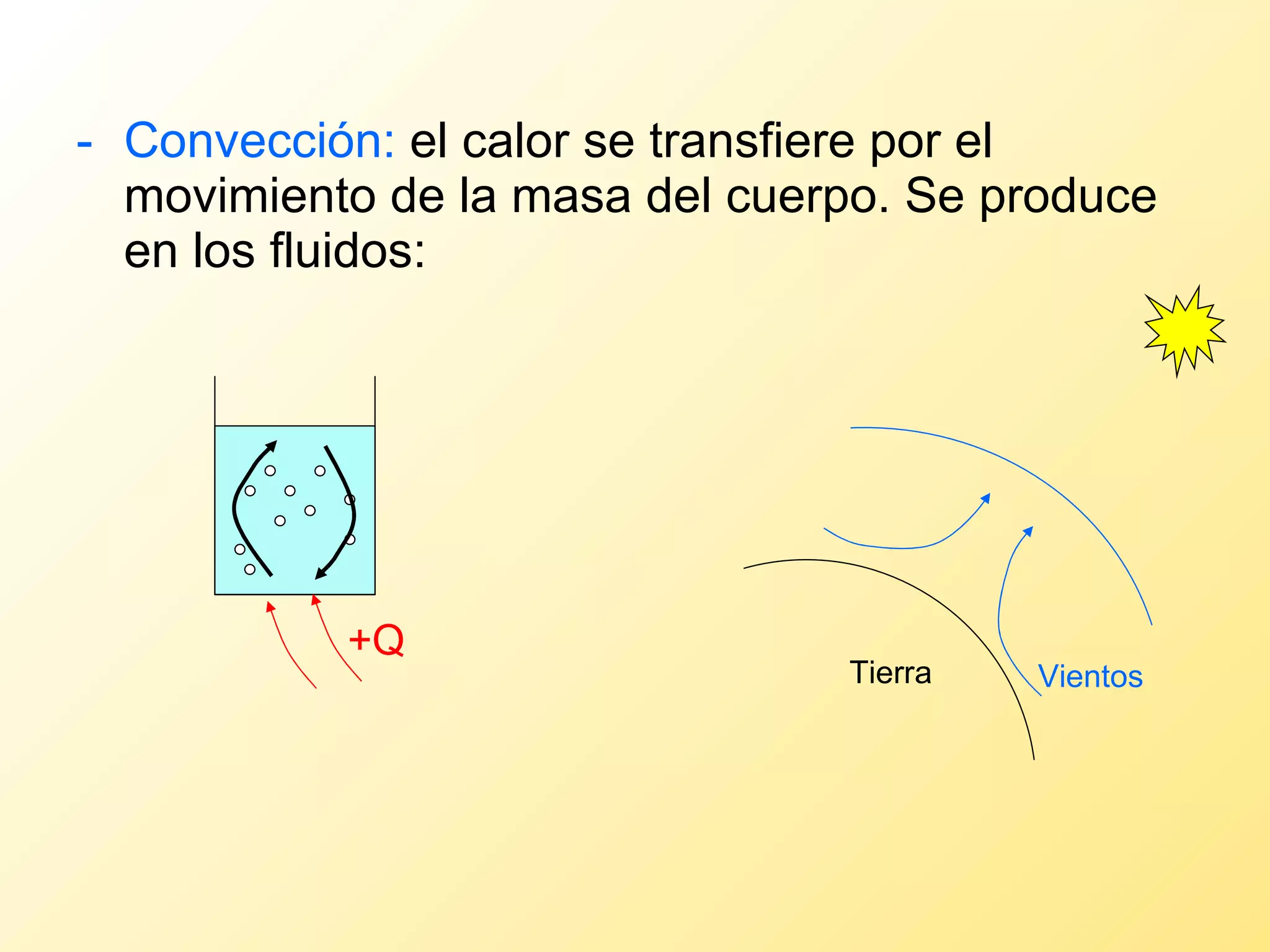
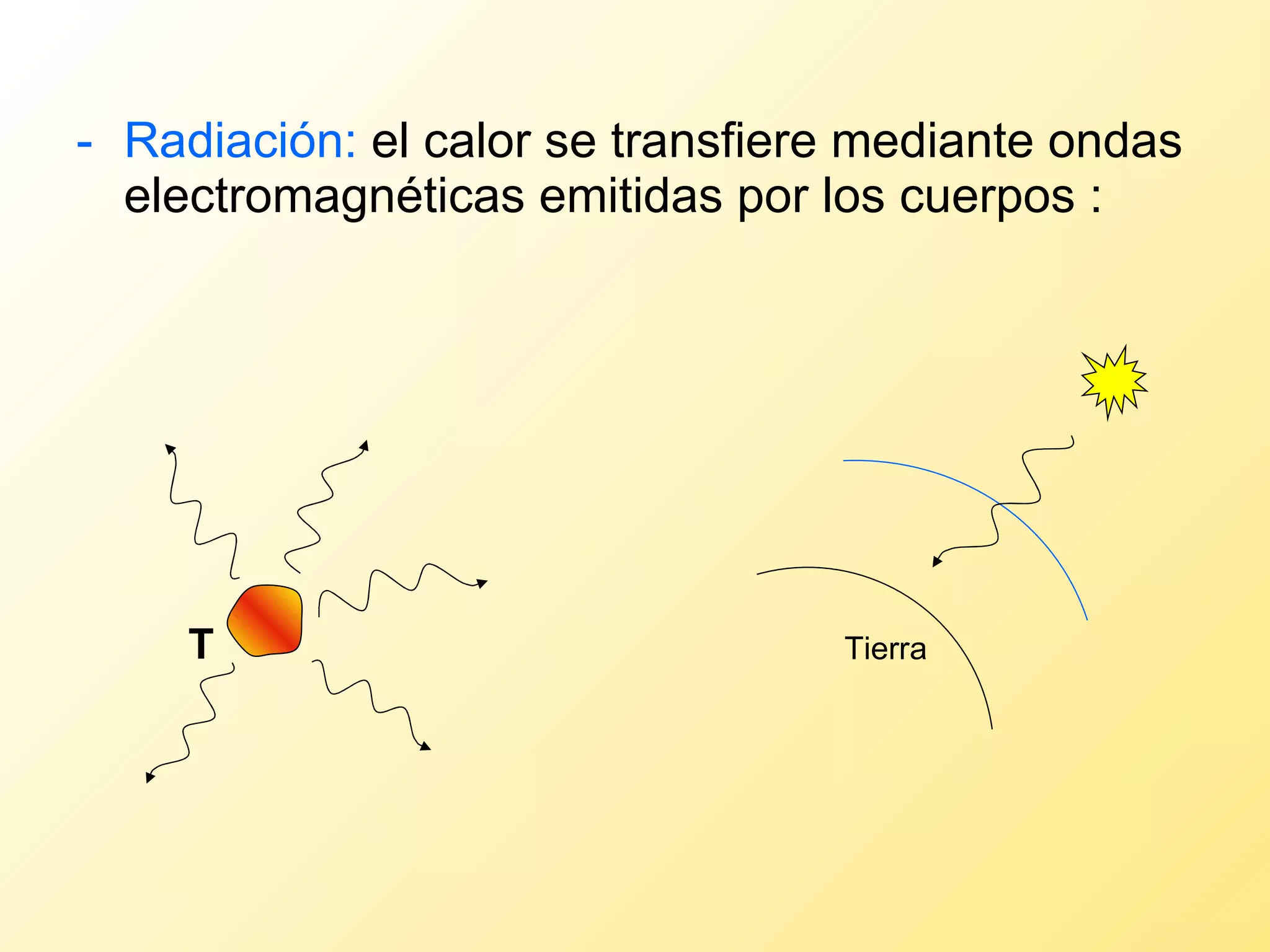
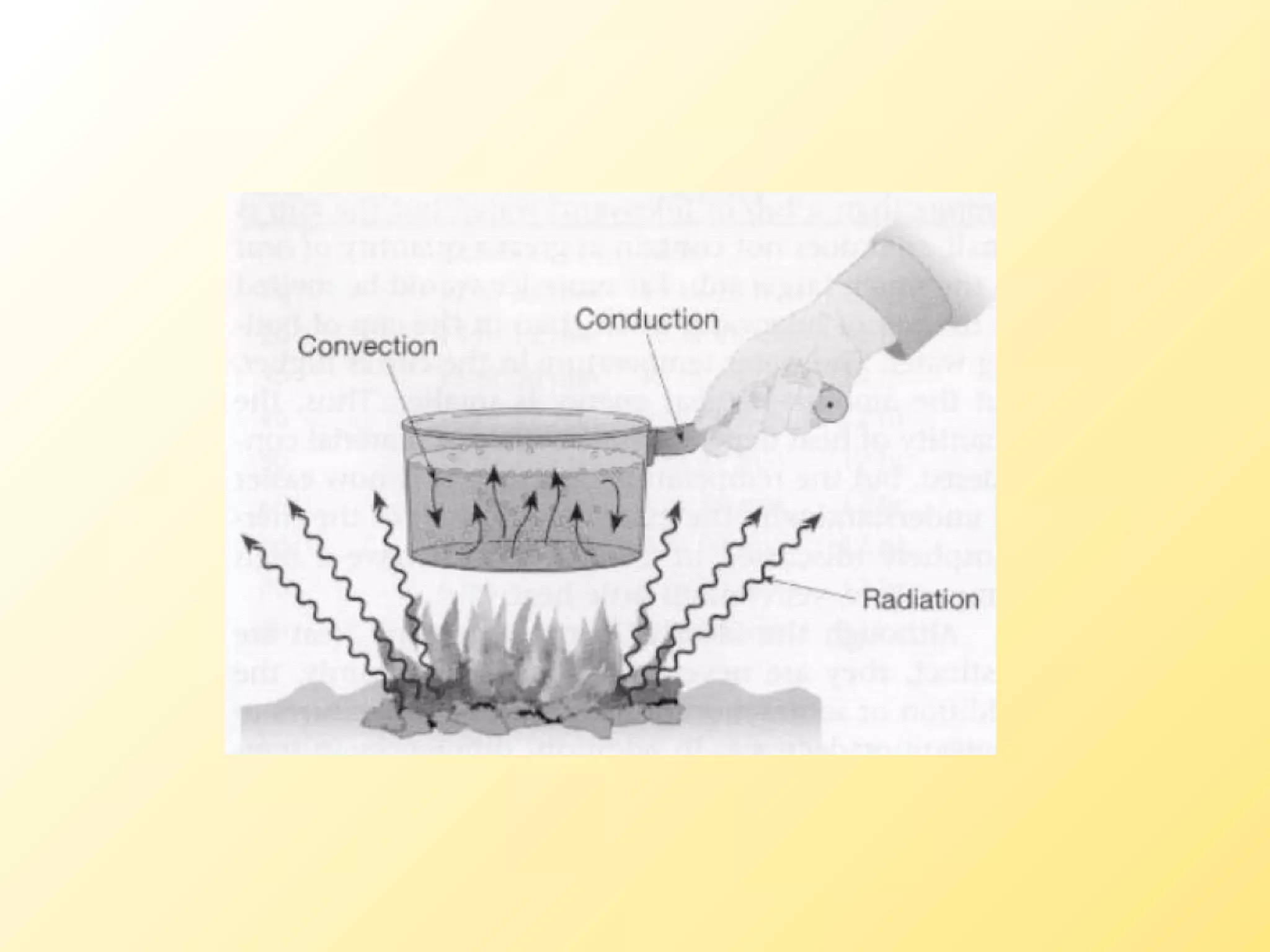
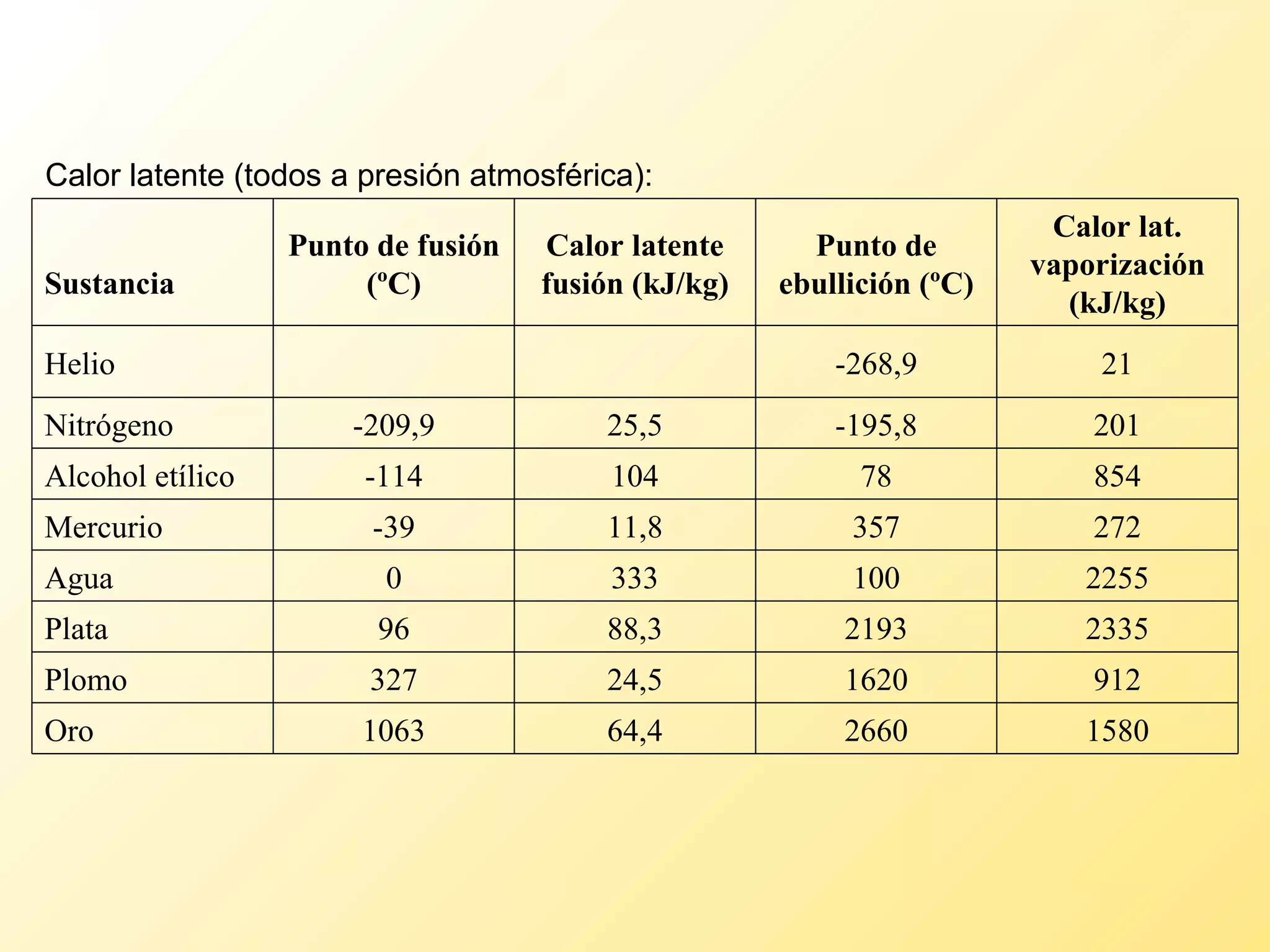
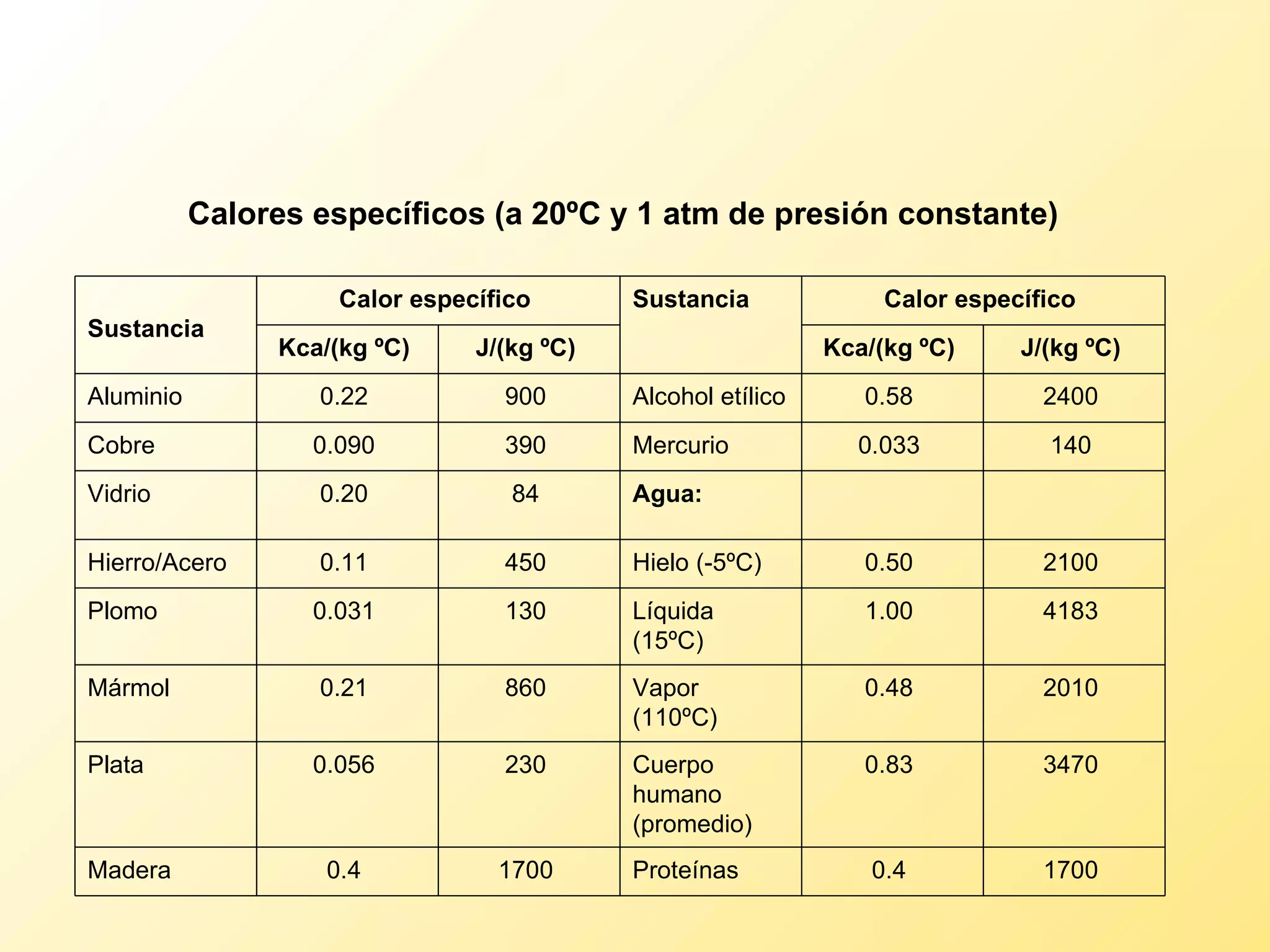
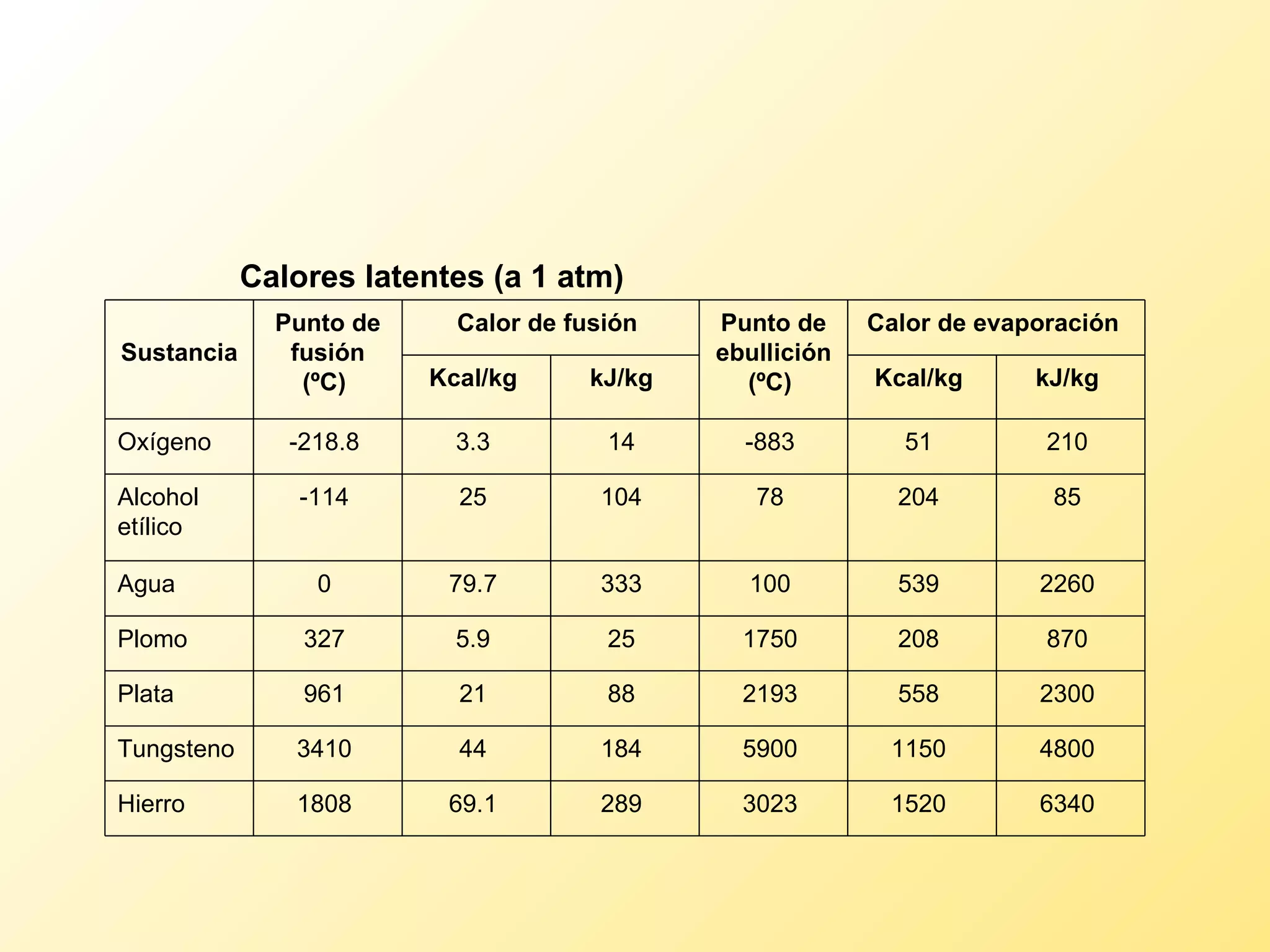
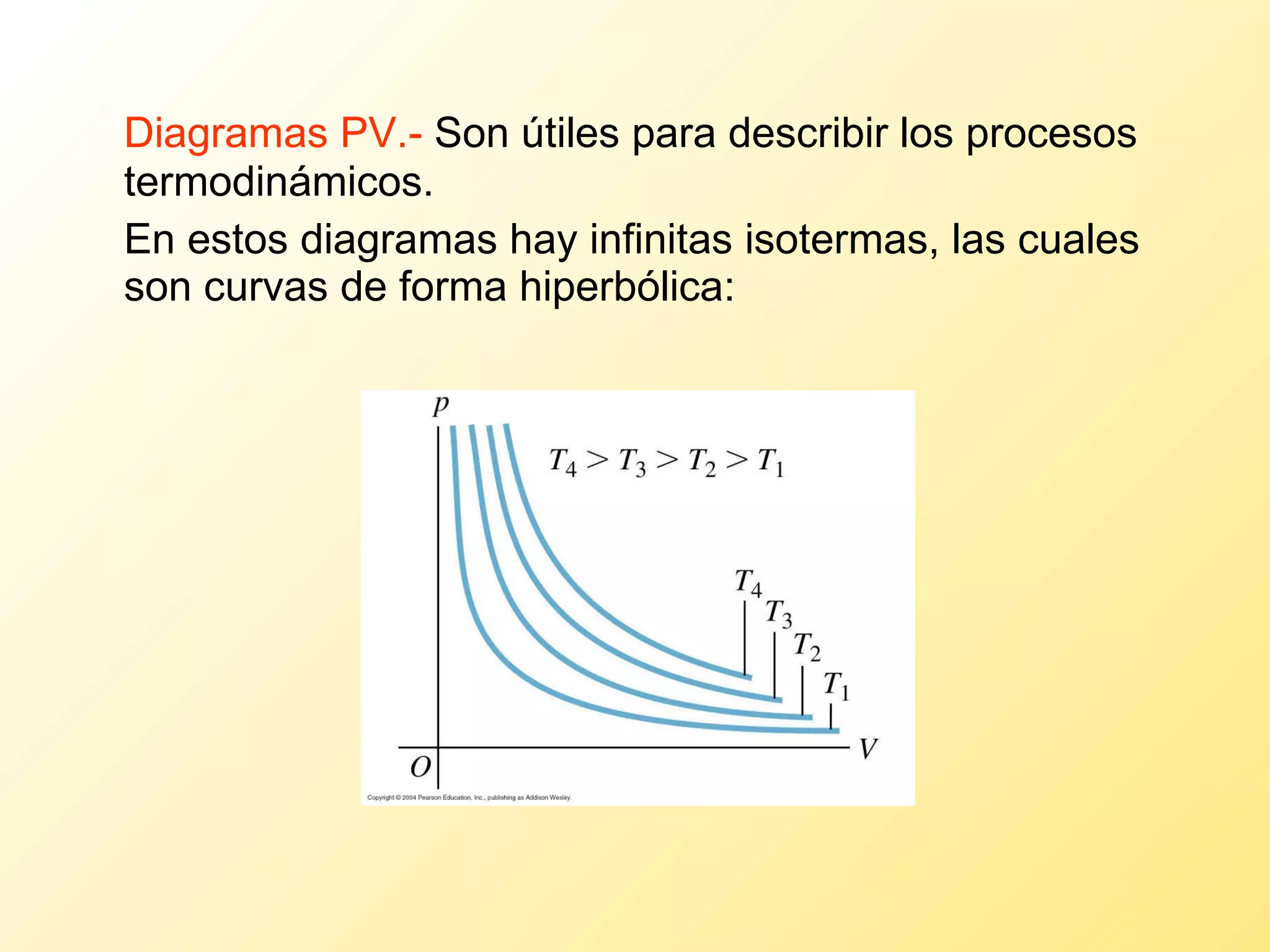
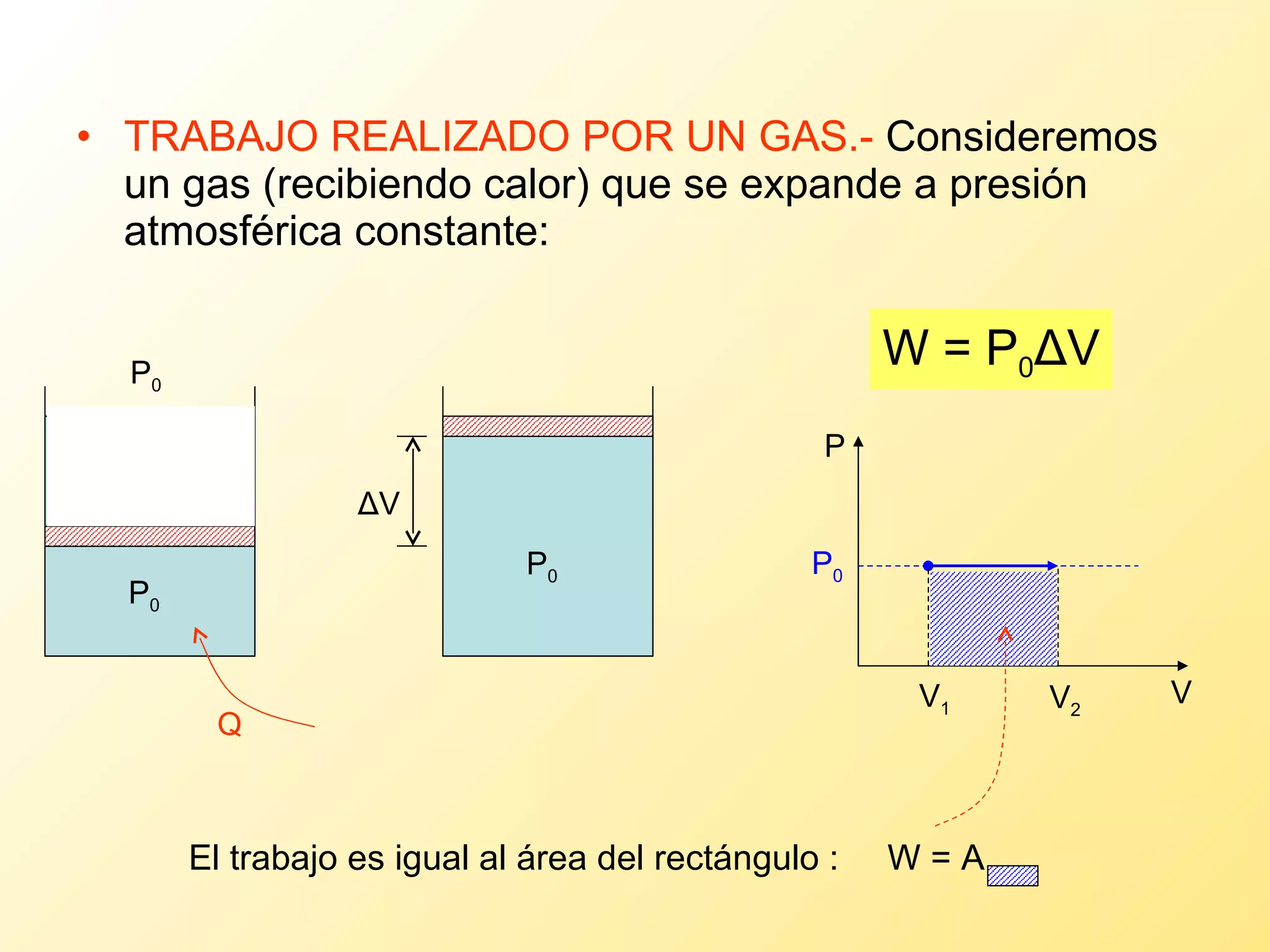
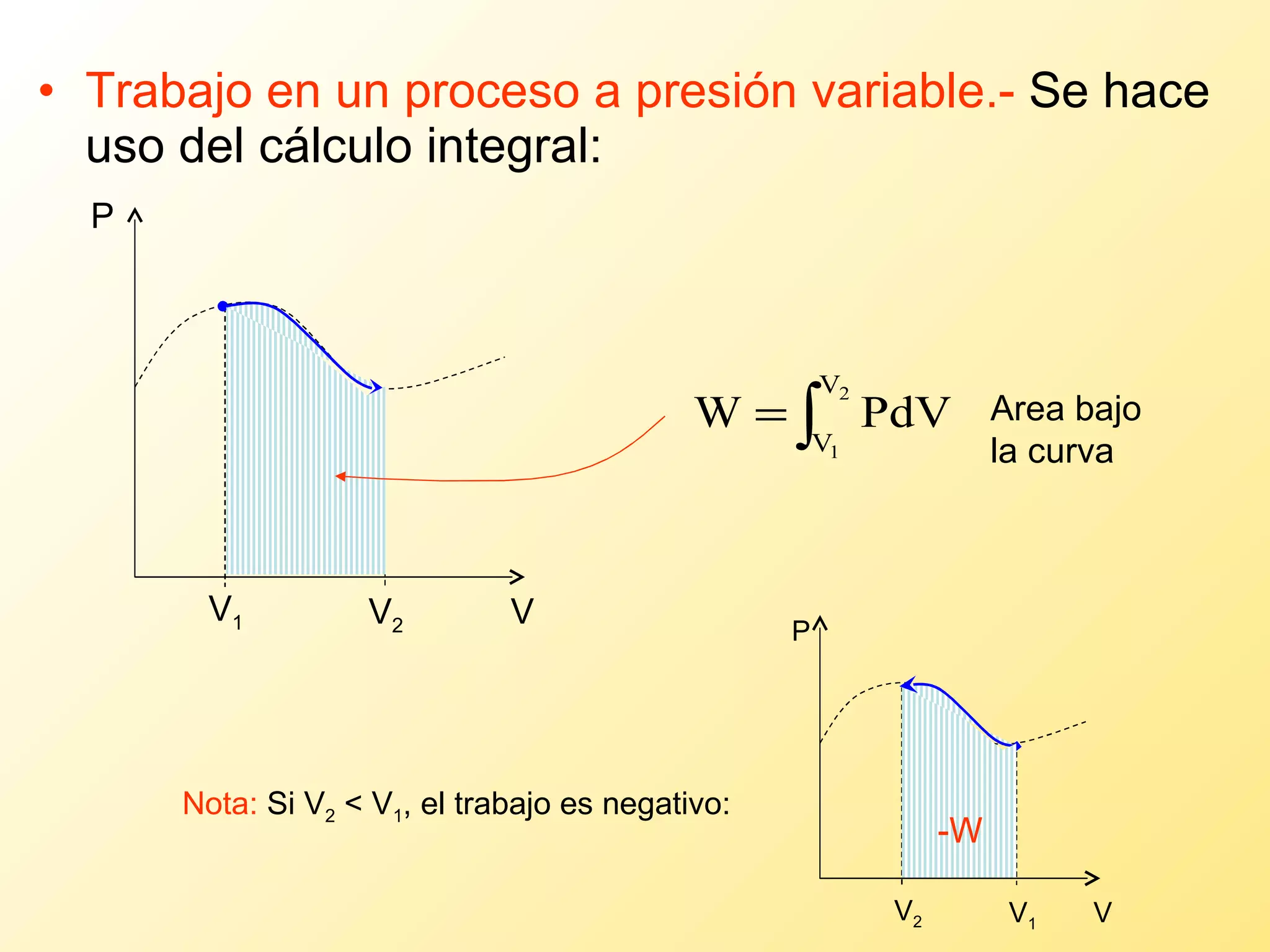
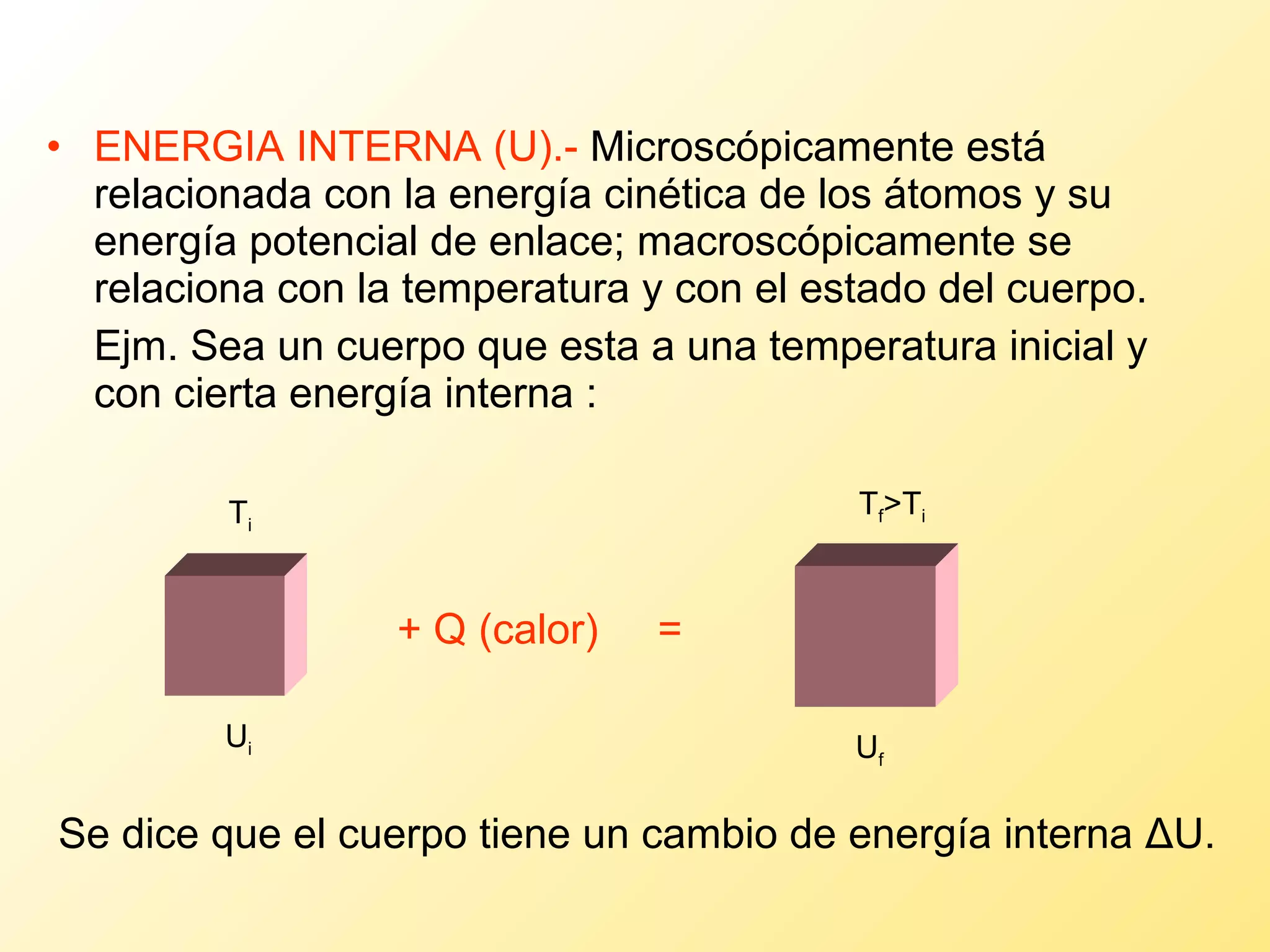
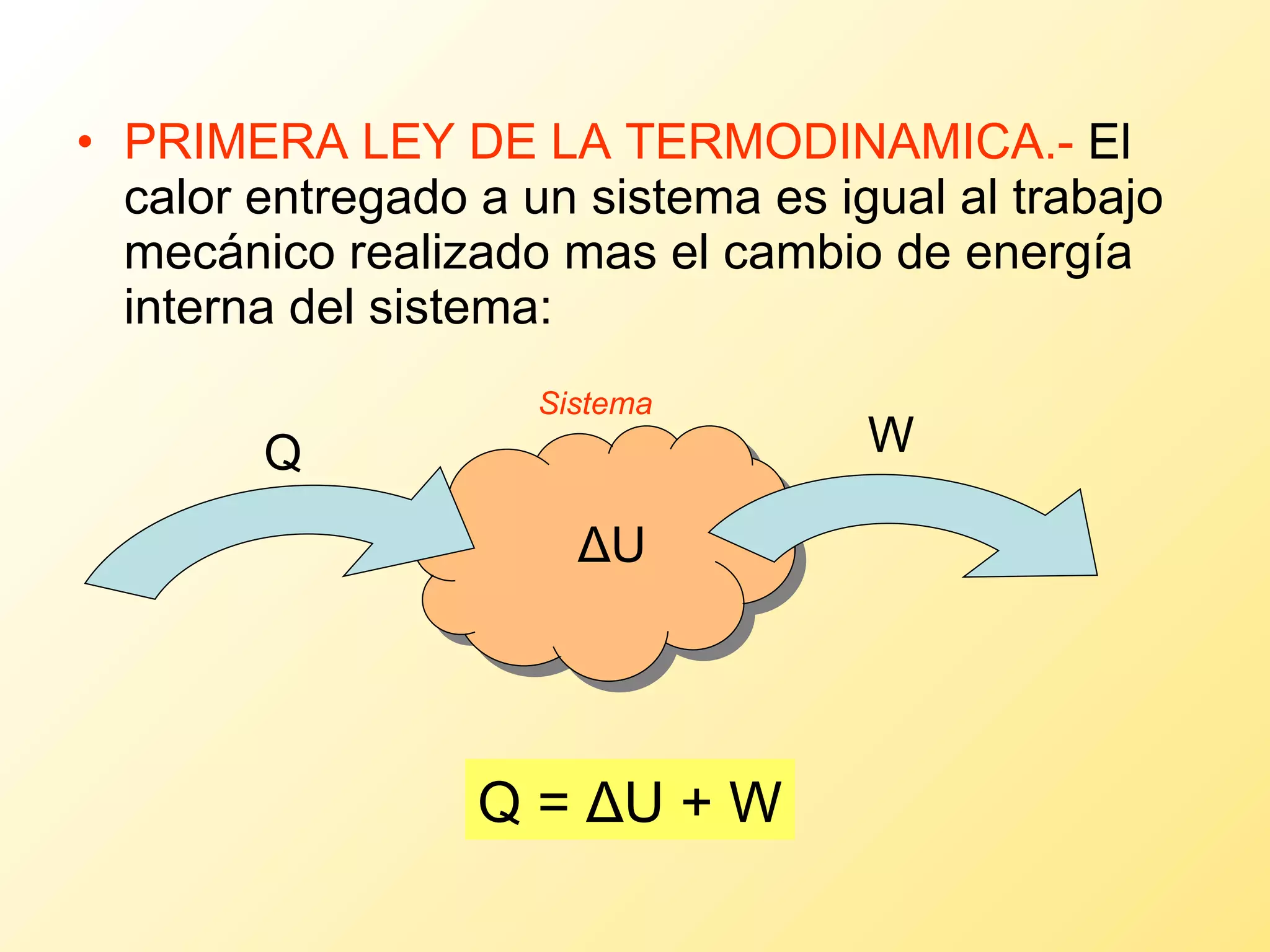
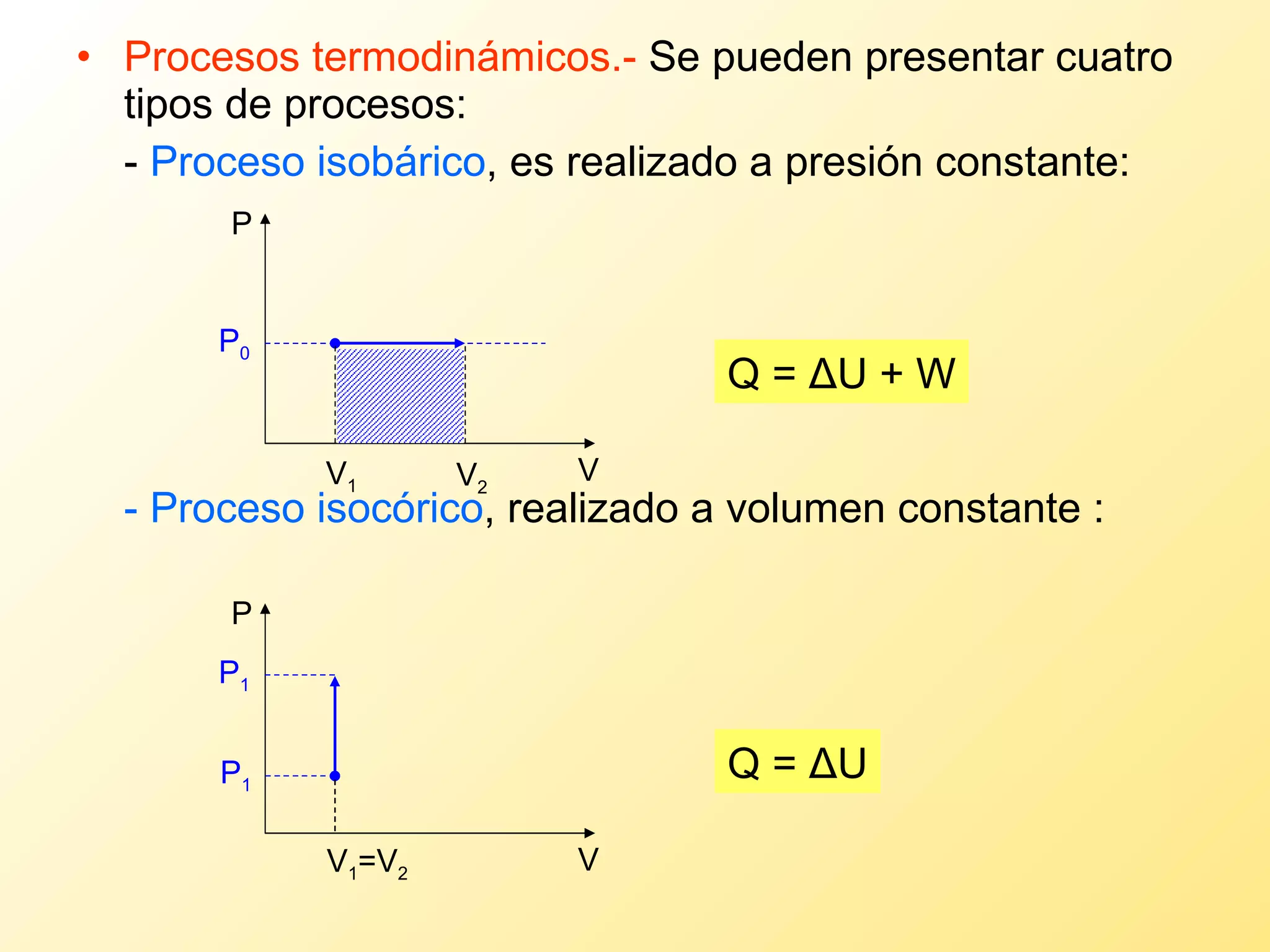
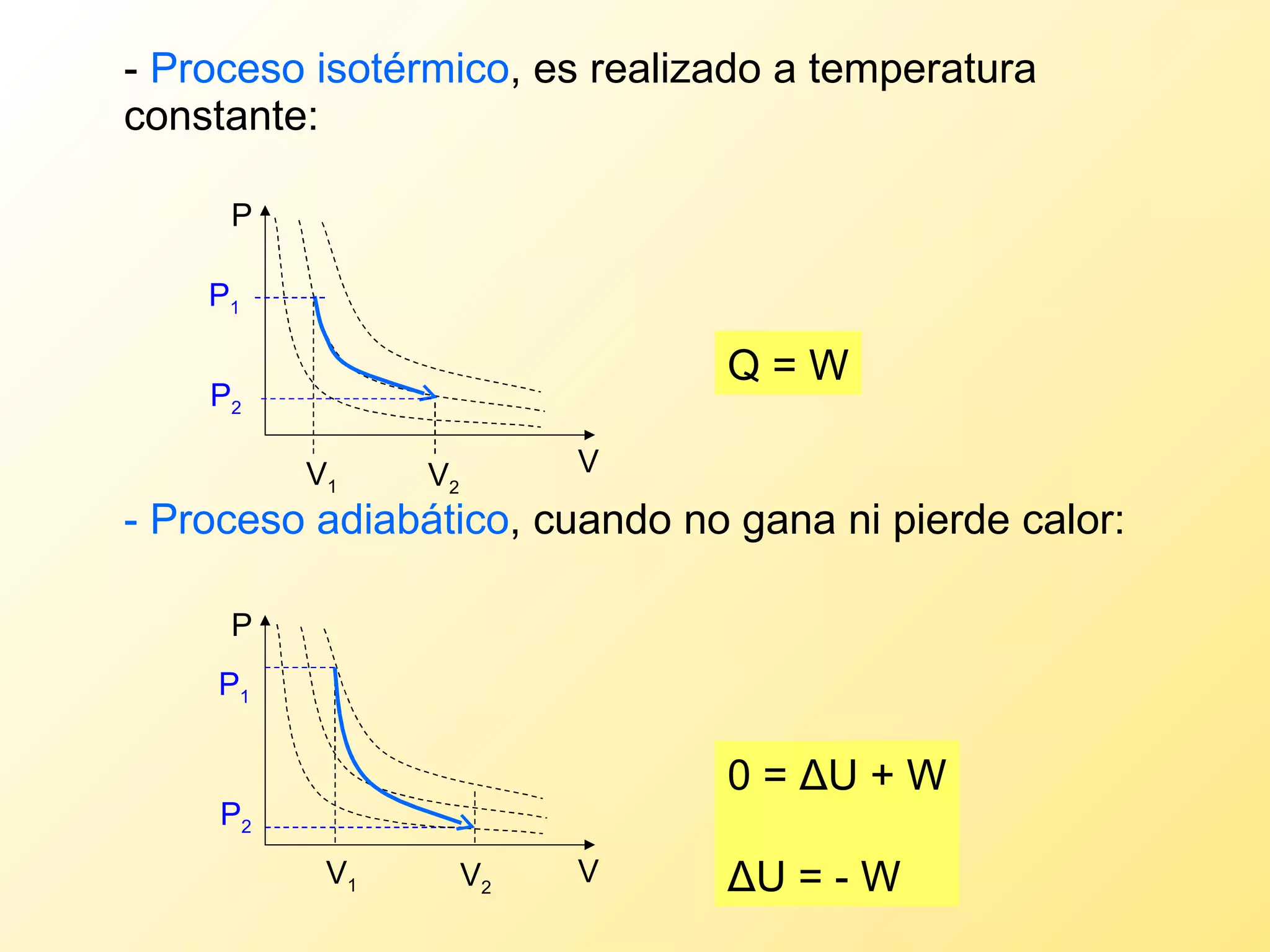
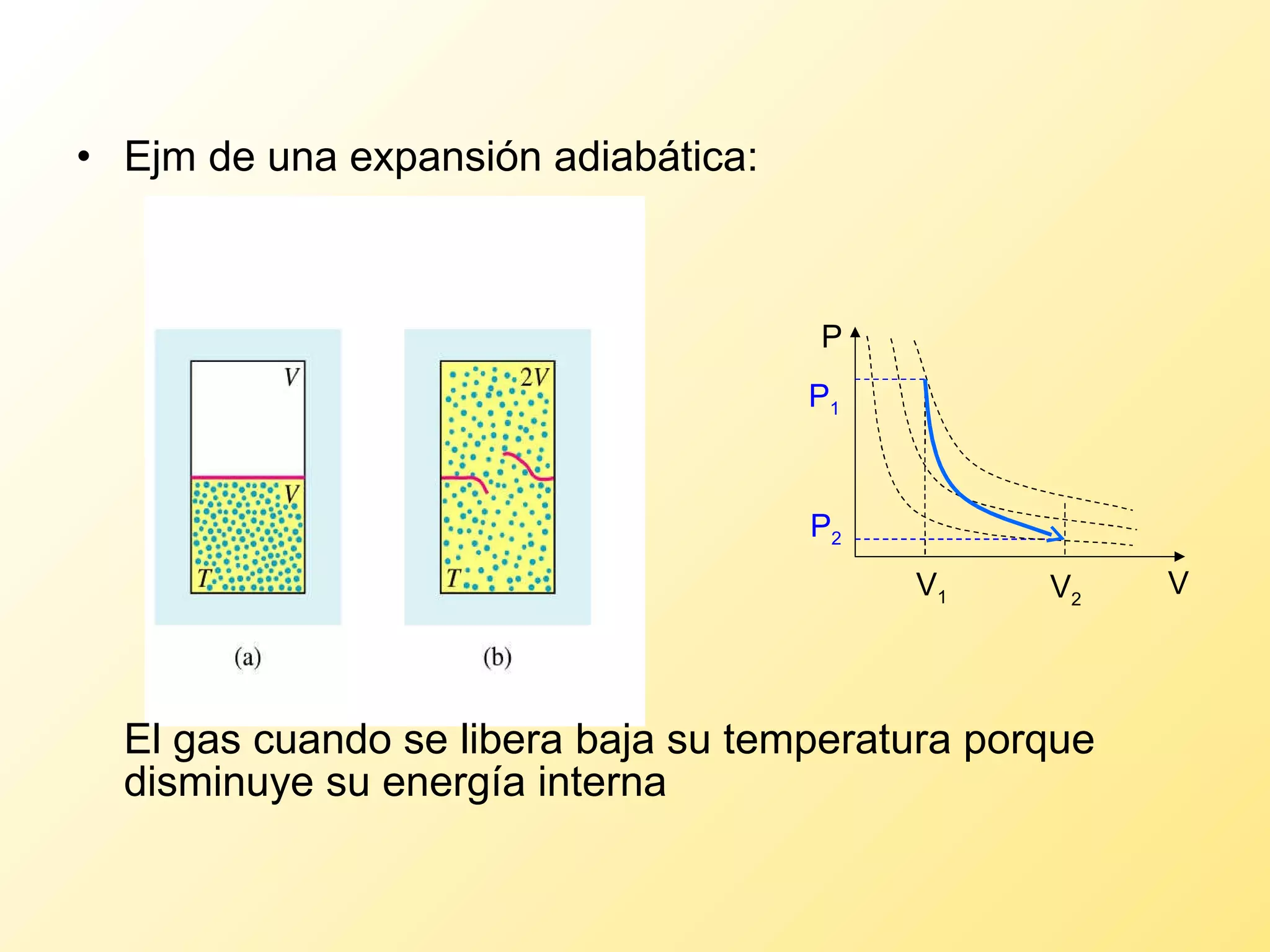
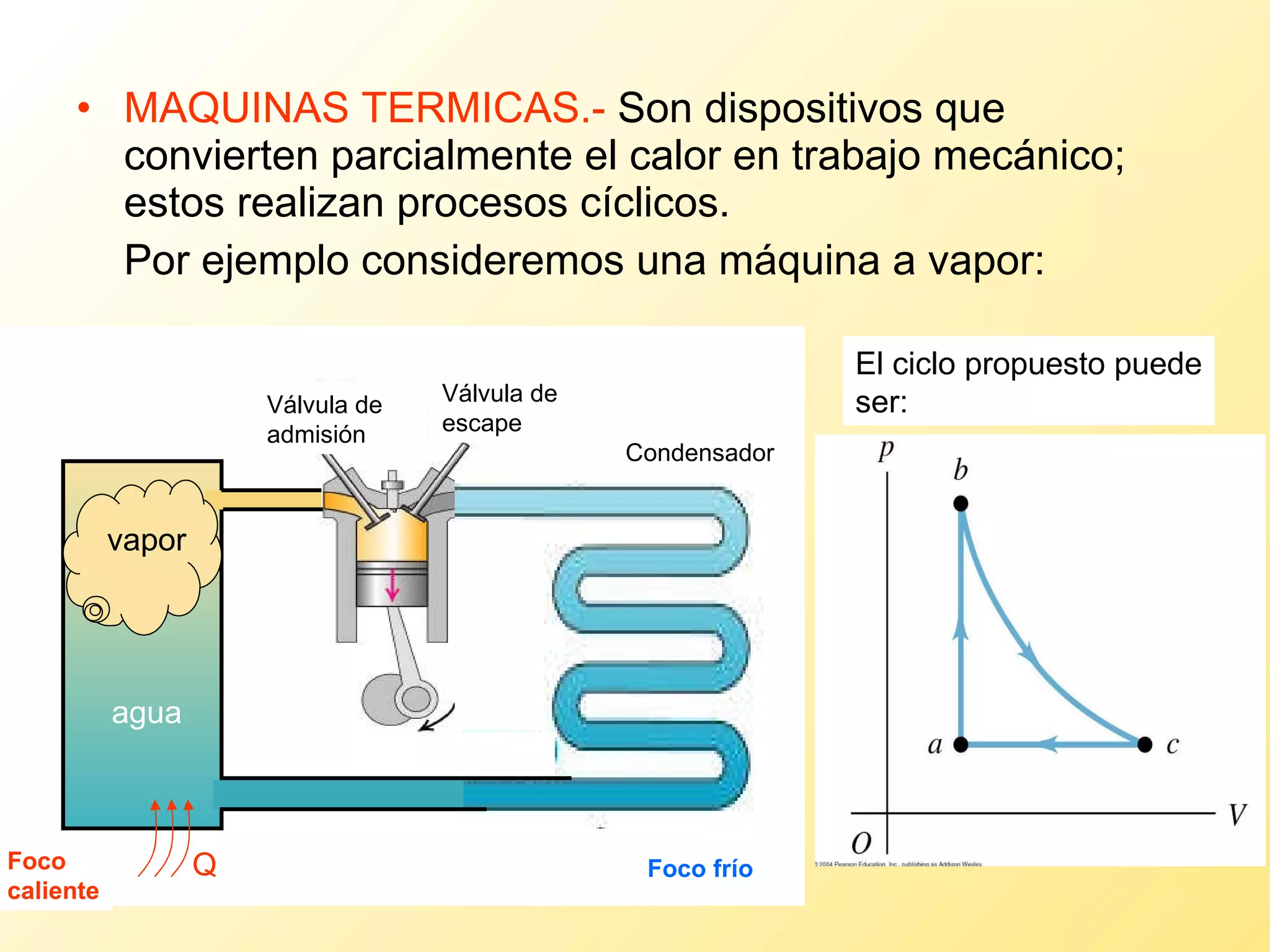
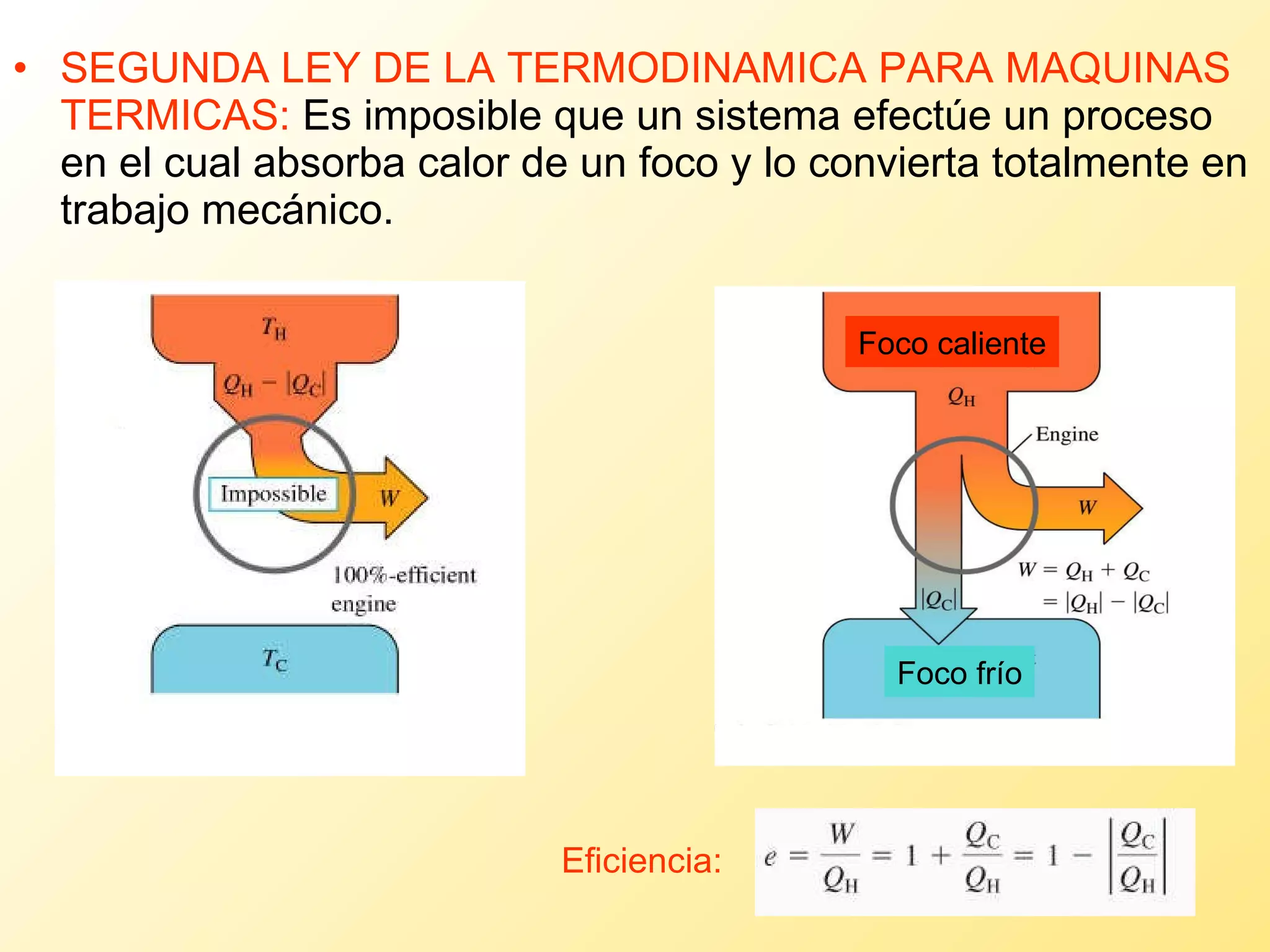
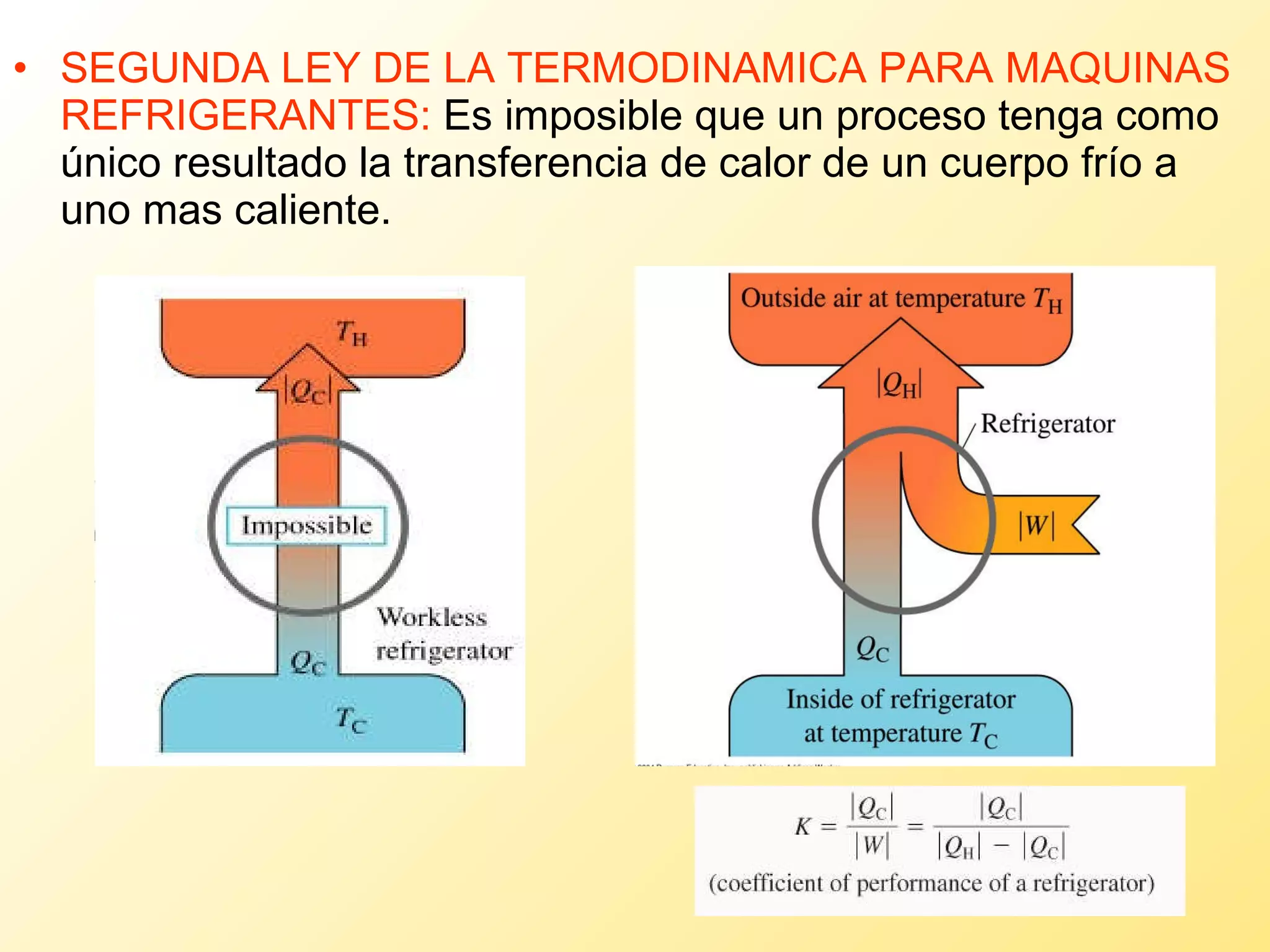
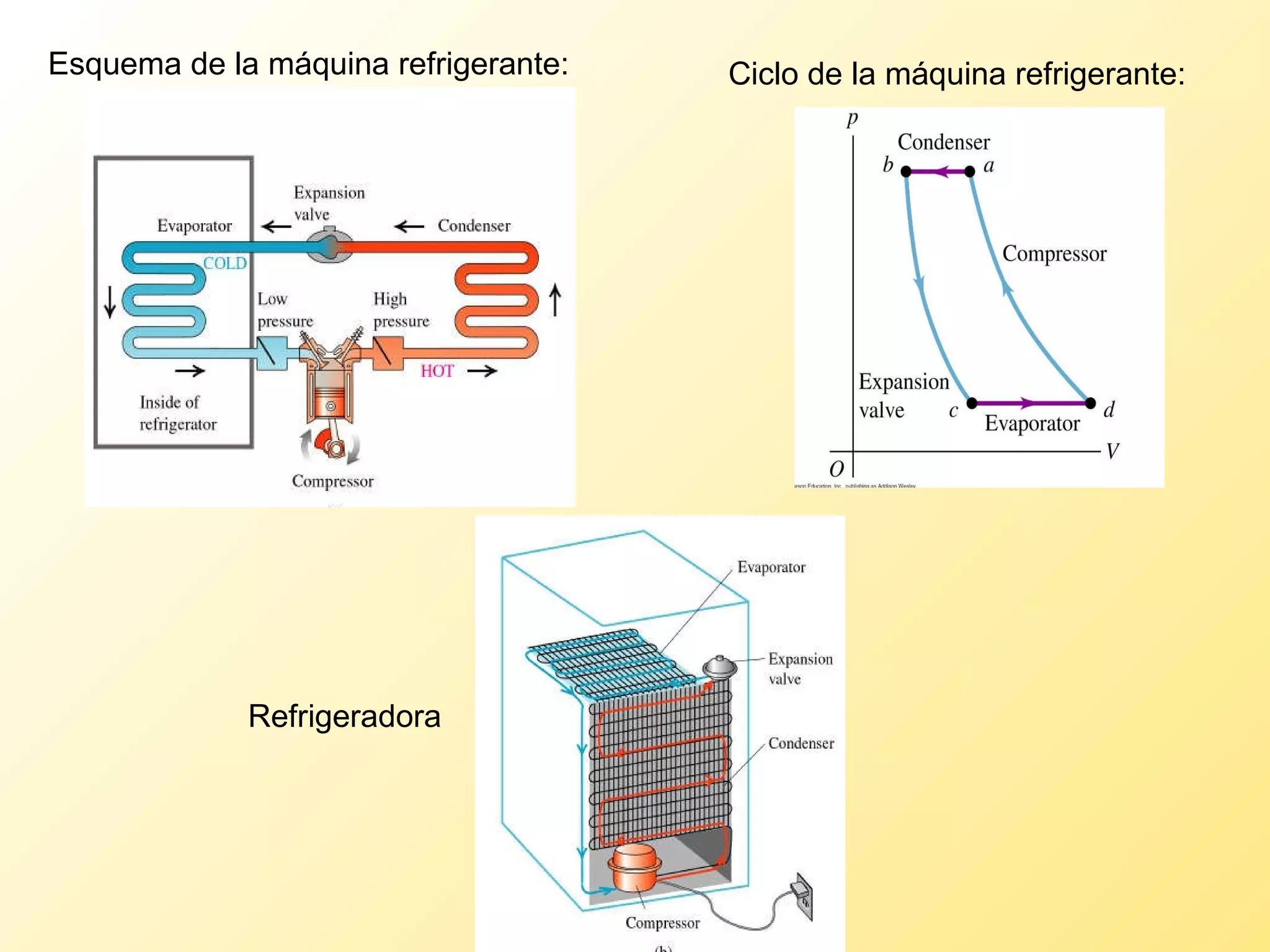
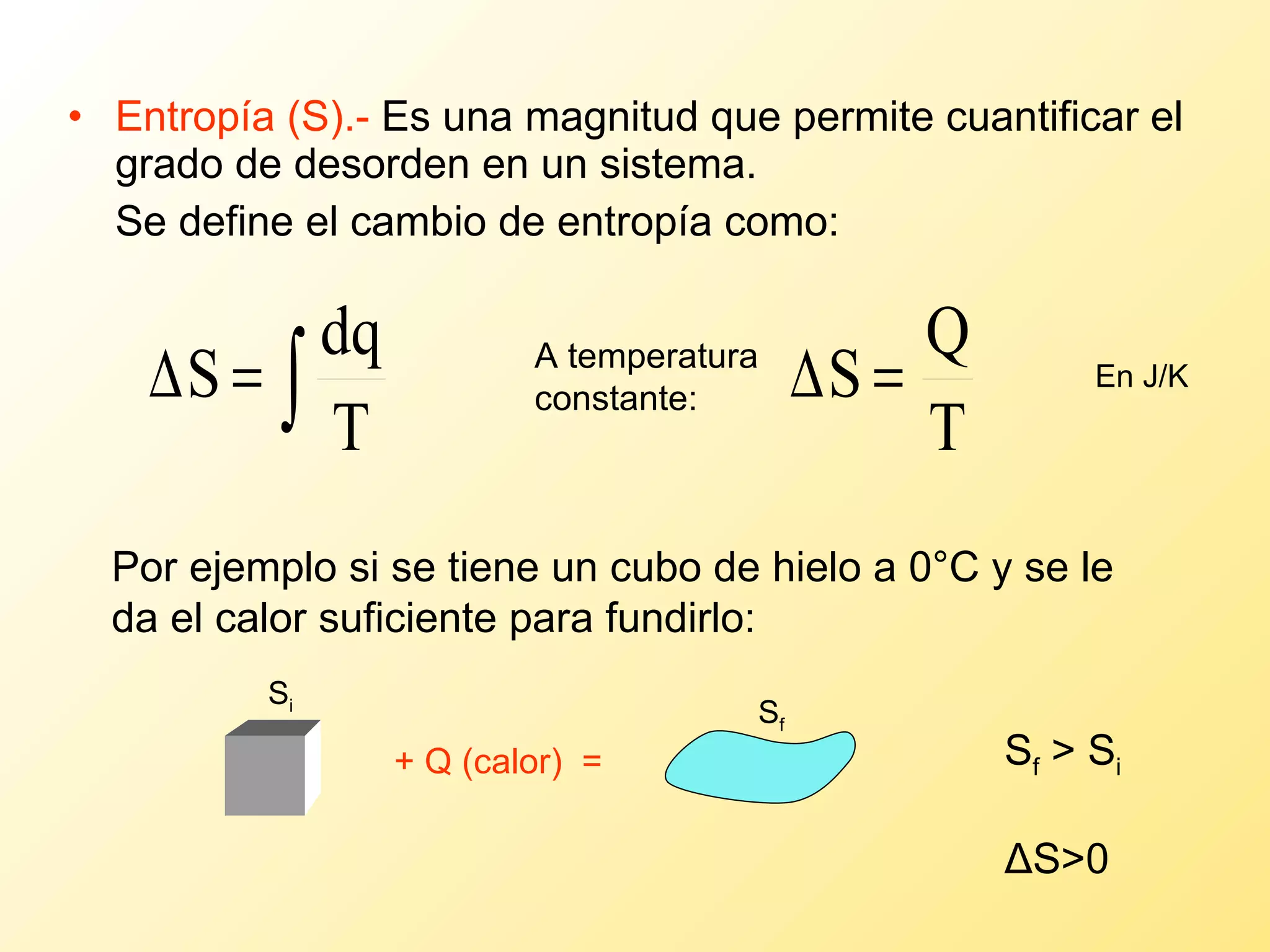
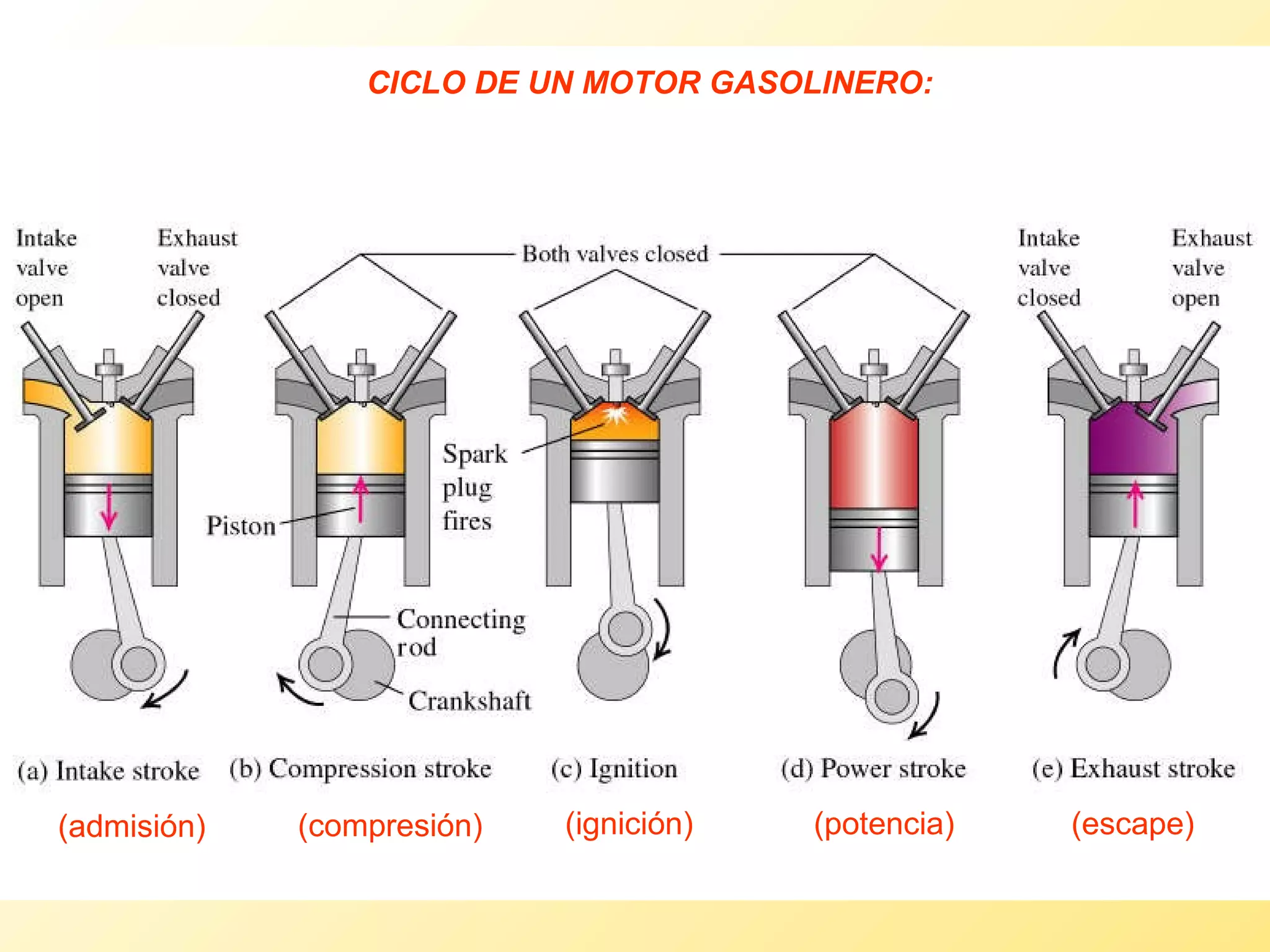
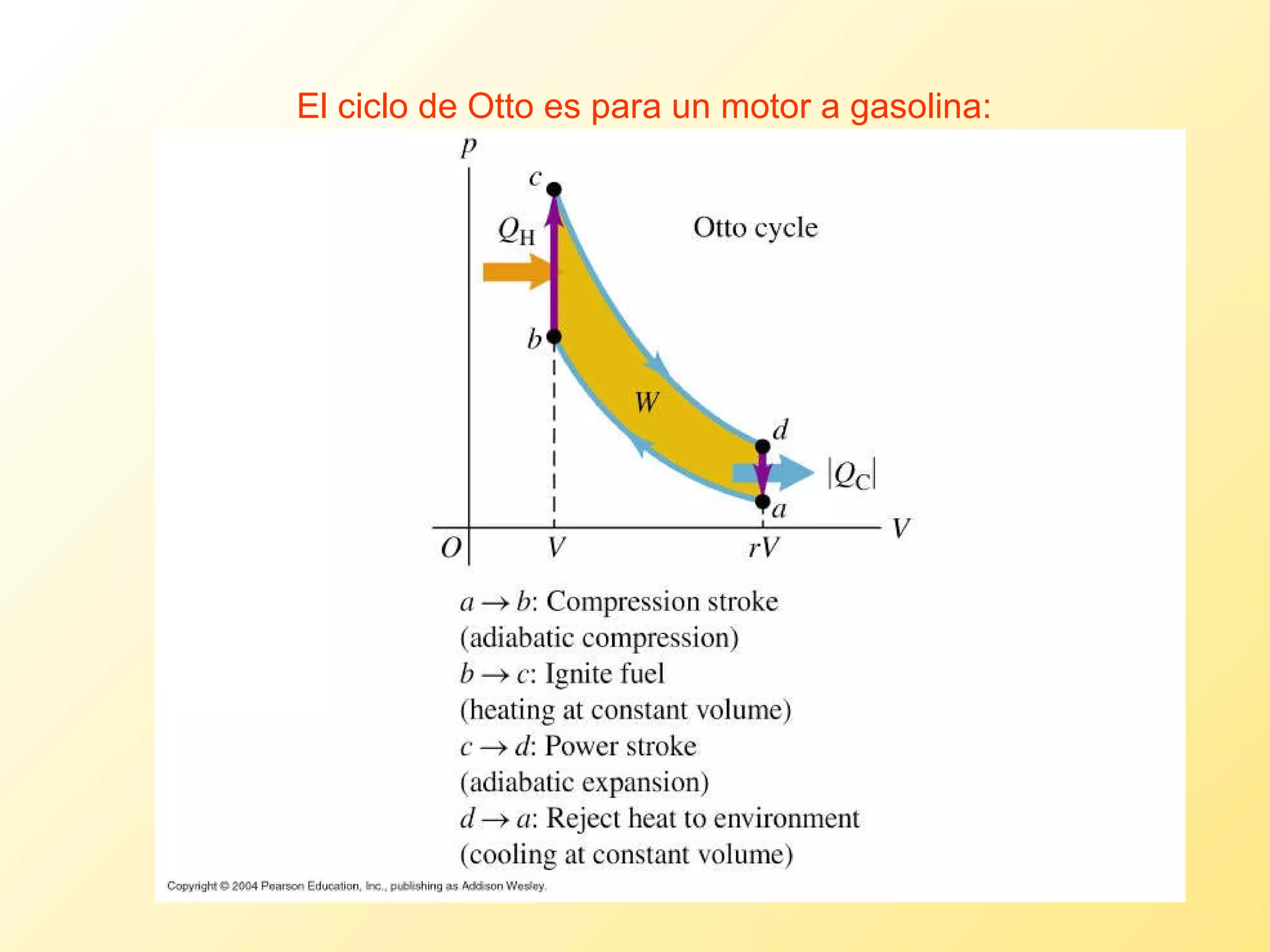
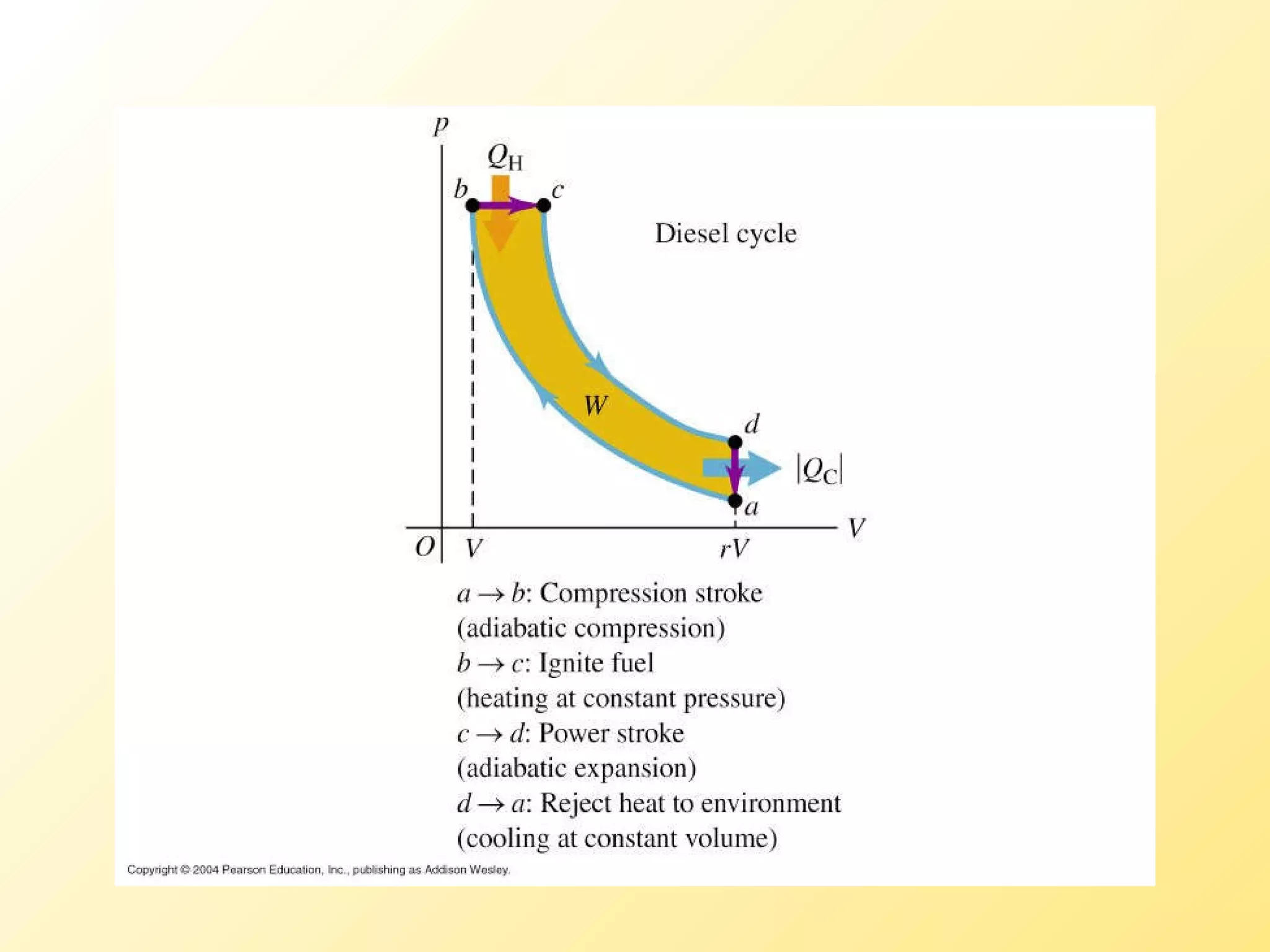
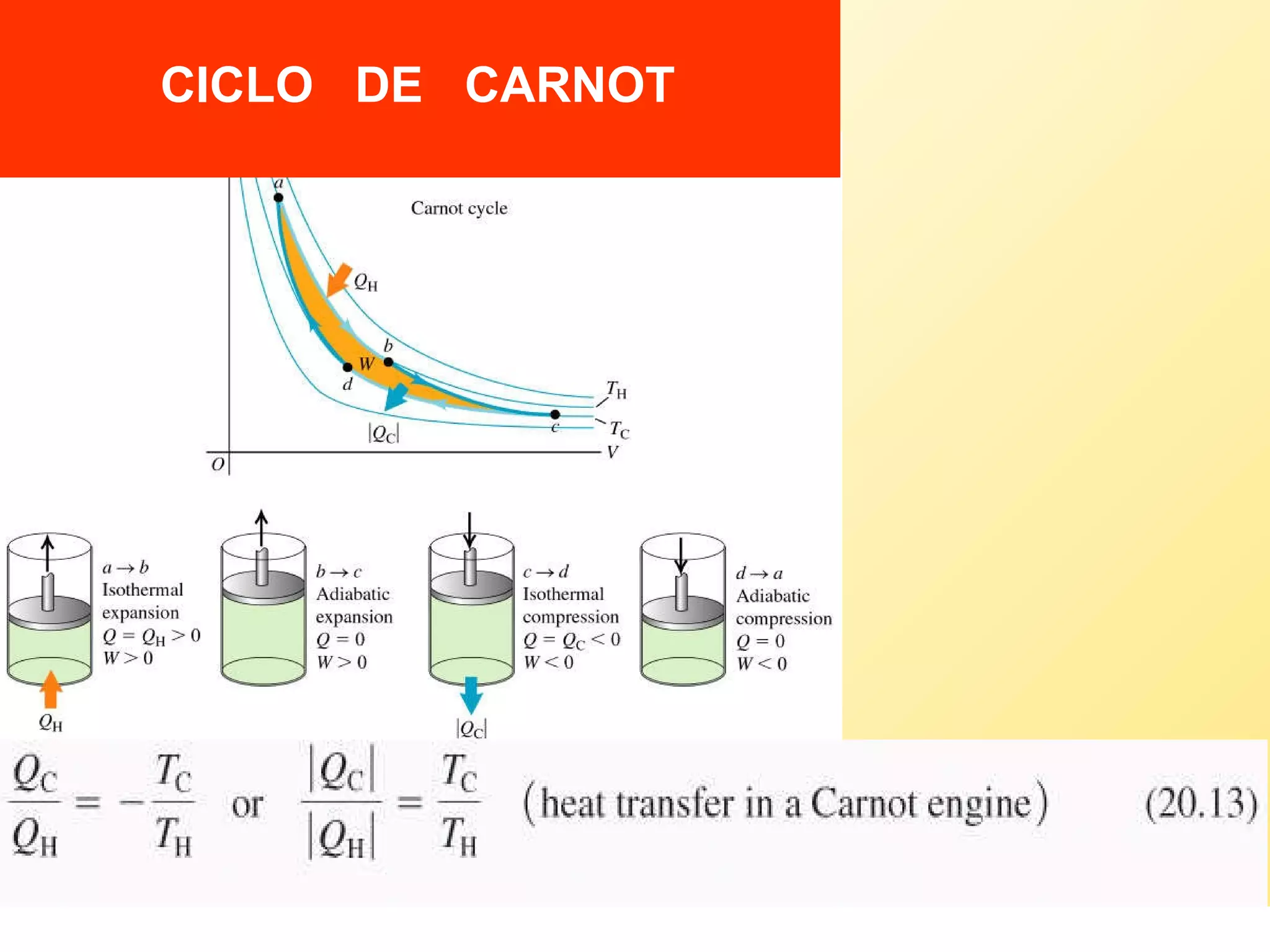
El documento aborda la temperatura y el calor desde un enfoque microscópico y macroscópico, definiendo el calor como la energía transferida entre cuerpos con diferencias de temperatura. También se analizan conceptos como dilatación térmica, calor específico, calor de fusión y vaporización, así como los principios de la termodinámica a través de la ecuación de estado de gases ideales y la primera y segunda ley de la termodinámica. Por último, se discuten los procesos termodinámicos, la eficiencia de los dispositivos que convierten calor en trabajo, y el concepto de entropía.