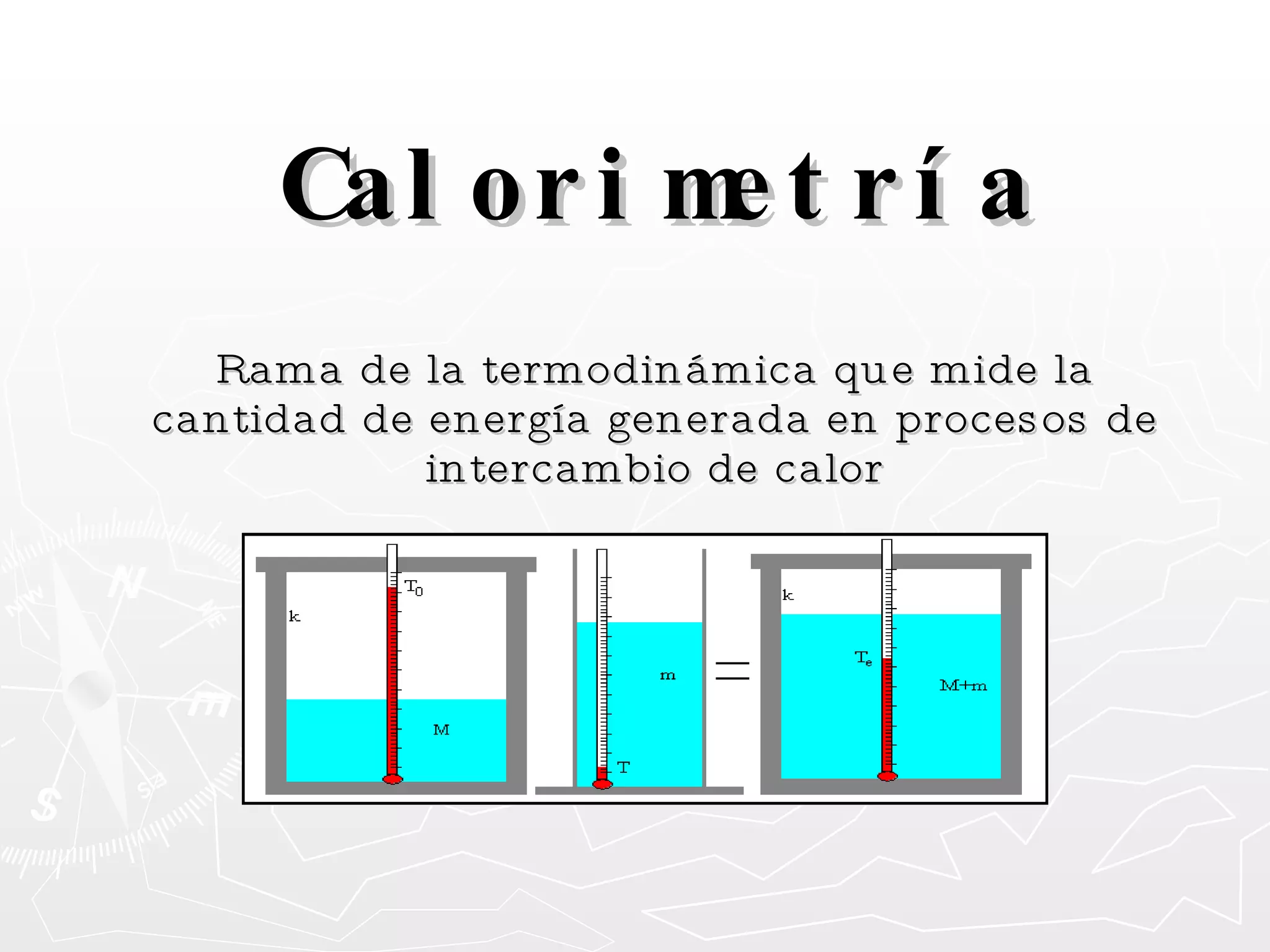
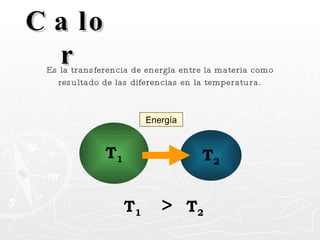
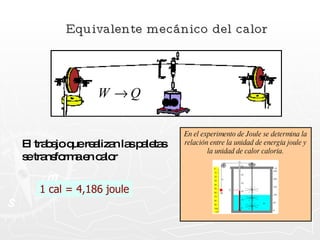
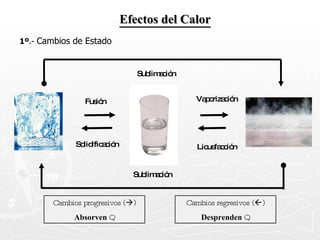
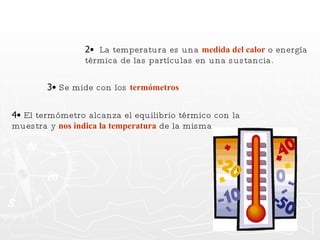
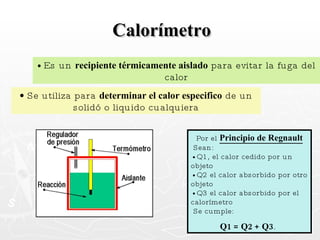
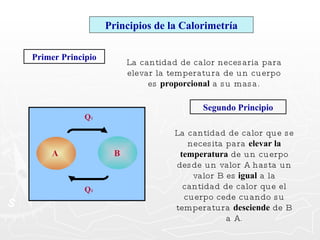
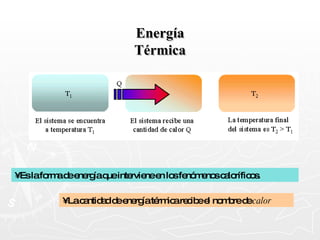
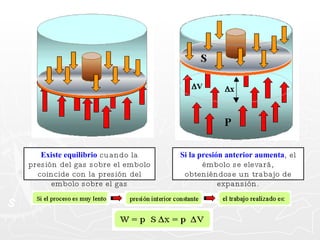
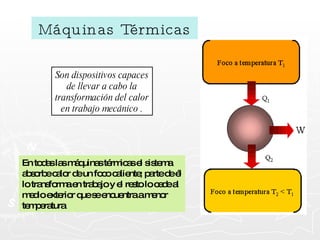
Este documento resume conceptos clave sobre calor y temperatura, incluyendo que el calor es una forma de energía que fluye de un cuerpo a otro debido a diferencias de temperatura, y que la temperatura es una medida de la energía térmica de las partículas en una sustancia. También explica los principios de la calorimetría, las diferentes escalas de temperatura, y los cambios de estado de la materia asociados con la transferencia de calor.

![Capacidad calorífica y Calor específico Es el calor que debe recibir una sustancia para que aumente su temperatura 1 ºC. Capacidad calorífica (C) Por lo tanto si una cantidad de calor Q produce un cambio en la temperatura de una sustancia se tiene: Unidad : [c] = cal / °C](https://image.slidesharecdn.com/calorimetra-090622193050-phpapp01/85/Calorimetria-5-320.jpg)
![Calor específico (c) Es la razón entre la capacidad calorífica (C) de un cuerpo y la masa (m) de dicho cuerpo. Unidad : [c] = cal / g °C • m es la masa de la sustancia en gramos . C agua = 1 cal/g.°C C hierro = 0,114 cal/g.°C C hielo = 0,5 cal/g.°C C latón = 0,094 cal/g.°C C aire = 0,24 cal/g.°C C mercurio = 0,033 cal/g.°C C aluminio = 0,217 cal/g.°C C cobre = 0,092 cal/g.°C C plomo = 0,03 cal/g.°C C plata = 0,056 cal/g.°C](https://image.slidesharecdn.com/calorimetra-090622193050-phpapp01/85/Calorimetria-6-320.jpg)

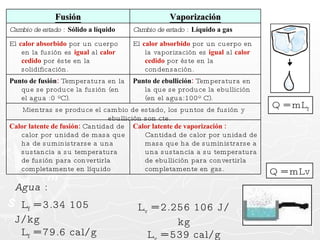
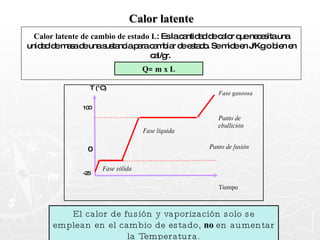
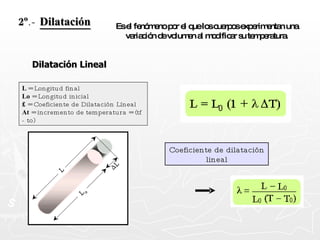
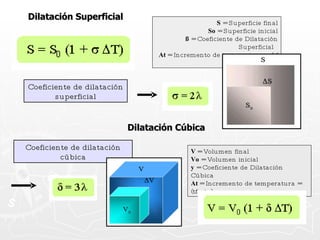

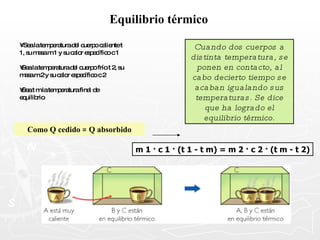





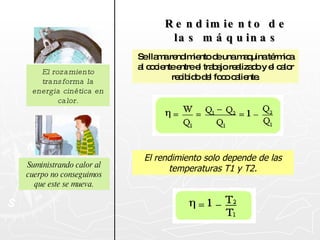
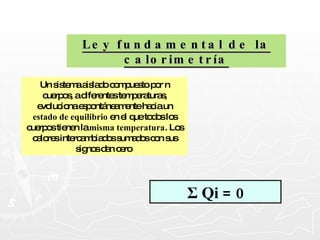
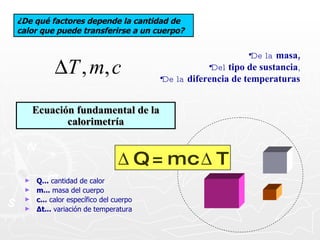
![¿Qué cantidad de calor necesita absorber un trozo de cobre cuya masa es 0.025 g si se encuentra a una temperatura de 8ºC y se desea que alcance una temperatura final de 20ºC? [ ce = 0,093 cal ] Q = m c T Q = 27,9 calorías Q = 25 g x 0.093 cal x 12º Q = 25 g x 0.093 cal x (20º - 8º ) 0.025 Kg. = 25 g](https://image.slidesharecdn.com/calorimetra-090622193050-phpapp01/85/Calorimetria-30-320.jpg)
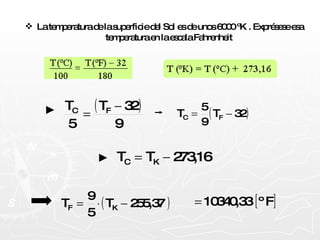
![Un trozo de hielo de 10 [gr] y temperatura –10 [ºC] se introducen en 1,5 [Kg] de agua a 75 [ºC]. Determine la temperatura final de la mezcla. Q1 + Q2 +Q3 + Q4 = 0](https://image.slidesharecdn.com/calorimetra-090622193050-phpapp01/85/Calorimetria-32-320.jpg)