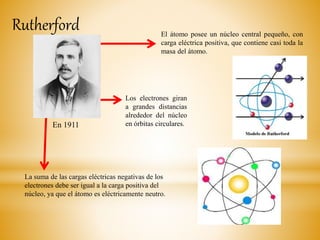
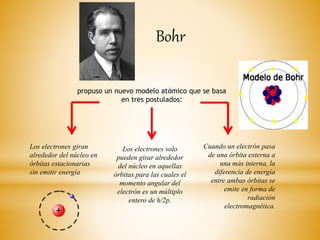
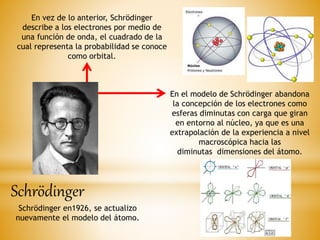
El documento resume la evolución histórica de la teoría atómica desde su concepción filosófica en la antigua Grecia hasta los modelos atómicos modernos propuestos por Thomson, Rutherford, Bohr y Schrödinger. Explica que la teoría atómica ganó amplia aceptación científica en el siglo XIX cuando los descubrimientos en química demostraron que la materia está compuesta de átomos discretos.