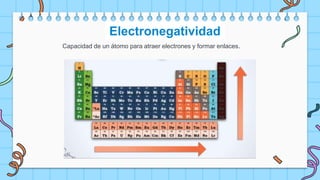
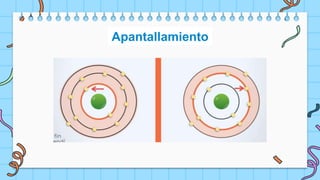
El documento describe la tabla periódica de los elementos, la cual fue desarrollada por Mendeleev y Meyer en 1869 para agrupar los 66 elementos conocidos de acuerdo a sus propiedades. La tabla periódica ayudó a predecir las propiedades de elementos aún no descubiertos y es actualizada por la IUPAC. Cada elemento tiene un lugar único determinado por su número atómico y configuración electrónica.