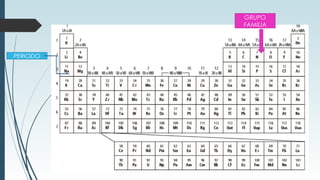
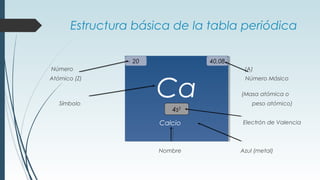
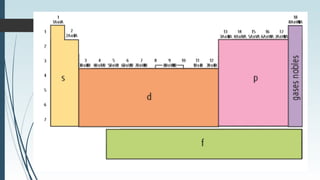
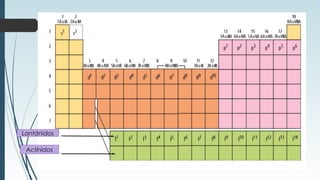
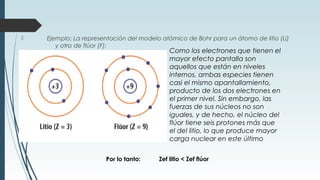
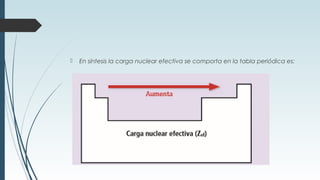
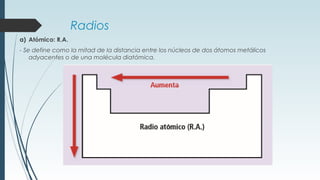
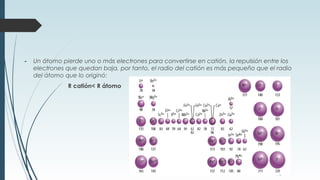
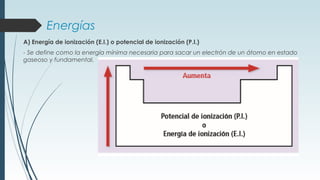
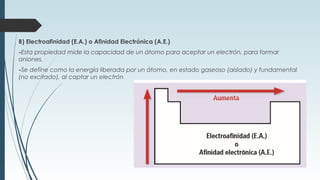
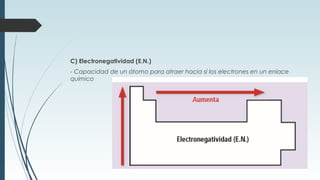
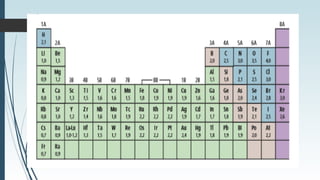
La tabla periódica describe la estructura y propiedades periódicas de los elementos. La tabla contiene siete períodos y 18 grupos. Las propiedades periódicas, como el radio atómico y la energía de ionización, varían sistemáticamente a lo largo de la tabla debido a cambios en la carga nuclear efectiva y la configuración electrónica de los elementos.