Solidos cristalinos
- 1. EL SILICIO El silicio es un elemento químico metaloide, número atómico 14 y situado en el grupo 3 de la tabla periódica de los elementos formando parte de la familia de los carbonoideos de símbolo Si.
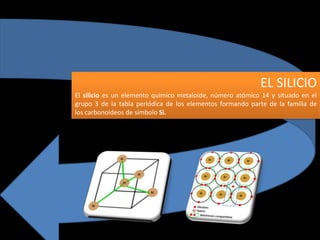
- 2. EL SILICIO ESTRUCTURA CRISTALINA La disposición de las silicio átomos en una celda unitaria, con los números que indican la altura del átomo encima de la base del cubo como una fracción de la dimensión de la celda. Silicio cristaliza en el mismo patrón que el de diamantes , en una estructura que Ashcroft y Mermin llaman "dos inter penetrantes centrados cara cúbicos" celosías primitivas. Las líneas entre los átomos de silicio en el entramado ilustración indican los bonos del vecino más próximo. El lado del cubo de silicio es 0.543 nm. El germanio tiene la estructura del diamante mismo con una dimensión de la celda de .566 nm
- 3. EL SILICIO PROPIEDADES Sus propiedades son intermedias entre las del carbono y el germanio. En PROPIEDADES ATOMICAS forma cristalina es muy duro y poco soluble y Radio medio 120 pm presenta un brillo metálico y color grisáceo. Electronegatividad 1,9 (Pauling) Polvo de Silicio Radio atómico (calc) 111 pm (Radio de Bohr) Aunque es un elemento relativamente inerte y Radio covalente 111 pm resiste la acción de la mayoría de los ácidos, Radio de van der Waals 210 pm reacciona con los halógenos yálcalis diluidos. El Estado(s) de oxidación 4 silicio transmite más del 95% de las longitudes Óxido Anfótero 1.ª Energía de ionización 786,5 kJ/mol de onda de la radiación infrarroja. 2.ª Energía de ionización 1577,1 kJ/mol 3.ª Energía de ionización 3231,6 kJ/mol 4.ª Energía de ionización 4355,5 kJ/mol 5.ª Energía de ionización 16091 kJ/mol 6.ª Energía de ionización 19805 kJ/mol 7.ª Energía de ionización 23780 kJ/mol 8.ª Energía de ionización 29287 kJ/mol Policristal de silicio 9.ª Energía de ionización 33878 kJ/mol 10.ª Energía de ionización 38726 kJ/mol PROPIEDADES FISICAS Estado ordinario Sólido (no magnético) Densidad 2330 kg/m3 Punto de fusión 1.687 K (1.414 °C) Punto de ebullición 3.173 K (2.900 °C) Entalpía de vaporización 384,22 kJ/mol Entalpía de fusión 50,55 kJ/mol Presión de vapor 4,77 Pa a 1683 K Olivino
- 4. EL SILICIO APLICACIONES Componentes de silicio se utilizan en las computadoras El Silicio orgánico favorece la síntesis de colágeno lo cual es básico en la formación del tejido conjuntivo. Como en los microprocesadores para computadoras, los componentes para relojes pueden ser grabados por láminas de silicio. Las rígidas placas de silicio podrían dar paso en unos años a otras más flexibles, baratas, eficientes y de múltiples aplicaciones.
- 5. EL GERMANIO Es un metaloide sólido duro, cristalino, de color blanco grisáceo lustroso, quebradizo, que conserva el brillo a temperaturas ordinarias. Presenta la misma estructura cristalina que el diamante y resiste a los ácidos y álcalis. Forma gran número de compuestos organometálicos y es un importante material semiconductor utilizado en transistores y fotodetectores. A diferencia de la mayoría de semiconductores, el germanio tiene una pequeña banda prohibida (band gap) por lo que responde de forma eficaz a la radiación infrarroja y puede usarse en amplificadores de baja intensidad.
- 6. EL GERMANIO ESTRUCTURA CRISTALINA El germanio tiene una apariencia metálica, pero exhibe las propiedades físicas y químicas de un metal sólo en condiciones especiales, dado que está localizado en la tabla periódica en donde ocurre la transición de metales a no metales. A temperatura ambiente hay poca indicación de flujo plástico y, en consecuencia, se comporta como un material quebradizo. Las propiedades del germanio son tales que este elemento tiene varias aplicaciones importantes, especialmente en la industria de los semiconductores. Presenta la misma estructura cristalina que el diamante (es cúbica) y resiste a los ácidos y álcalis. Este diagrama muestra un ordenamiento de átomos en una "celda unitaria" de germanio.
- 7. Germanio EL GERMANIO PROPIEDADES PROPIEDADES ATOMICAS Sus propiedades son intermedias entre las Radio medio 125 pm del carbono y el germanio. En Electronegatividad 2,01 (Pauling) forma cristalina es muy duro y poco soluble y Radio atómico (calc) 125 pm (Radio de Bohr) presenta un brillo metálico y color grisáceo. Radio covalente 122 pm Aunque es un elemento relativamente inerte y Radio de van der Waals Sin datos pm Estado(s) de oxidación 4, 3, 2, 1, 0, -1, -2, -3, -4 resiste la acción de la mayoría de los ácidos, Óxido Anfótero reacciona con los halógenos yálcalis diluidos. El 1.ª Energía de ionización 762 kJ/mol silicio transmite más del 95% de las longitudes 2.ª Energía de ionización 1537,5 kJ/mol de onda de la radiación infrarroja. 3.ª Energía de ionización 3302,1 kJ/mol 4.ª Energía de ionización 4411 kJ/mol 5.ª Energía de ionización 9020 kJ/mol PROPIEDADES FISICAS Estado ordinario Sólido Densidad 5323 kg/m3 Punto de fusión 1.211,4 K (938 °C) Punto de ebullición 3.093 K (2.820 °C) Entalpía de vaporización 330,9 kJ/mol Entalpía de fusión 36,94 kJ/mol Presión de vapor 0,0000746 Pa a 1210 K
- 8. EL GERMANIO APLICACIONES componente fundamental para la fabricación de fibra óptica. El Germanio produce una gran cantidad de beneficios en el organismo Se utiliza como semiconductor. El germanio dopado con arsénico, galio, u otros elementos se utiliza como transistor. Por ser transparente a la radiación infrarroja se emplea en forma de monocristales en espectroscopios infrarrojos (lentes, prismas y ventanas) y otros aparatos ópticos entre los que se encuentran detectores infrarrojos extremadamente sensibles. El óxido de germanio se aplica en lentes gran angular de cámaras y en objetivos de microscopio. El germanio se utiliza como detector de la radiación gamma. Los compuestos organogermánicos se están utilizando en quimioterapia, pues tienen poca toxicidad para los mamíferos y son eficaces contra ciertas bacterias
- 9. GALIO El galio es un metal blando, grisáceo en estado líquido y plateado brillante al solidificar, sólido deleznable a bajas temperaturas que funde a temperaturas cercanas a la del ambiente (como cesio, mercurio y rubidio) e incluso cuando se sostiene en la mano por su bajo punto de fusión (28,56 °C). El rango de temperatura en el que permanece líquido es uno de los más altos de los metales (2174 °C separan sus punto de fusión y ebullición) y la presión de vapor es baja incluso a altas temperaturas. El metal se expande un 3,1% al solidificar y flota en el líquido al igual que el hielo en el agua.
- 10. GALIO ESTRUCTURA CRISTALINA La cristalización no se produce en ninguna de las estructuras simples; la fase estable en condiciones normales es ortorrómbica, con 8 átomos en cada celda unitaria en la que cada átomo sólo tiene otro en su vecindad más próxima a una distancia de 2,44 Å y estando los otros seis a 2,83 Å. En esta estructura el enlace químico formado entre los átomos más cercanos es covalente siendo la molécula Ga2 la que realmente forma el entramado cristalino. A otra presión y temperatura se han encontrado numerosas fases estables y metaestables distintas. El galio corroe otros metales al difundirse en sus redes cristalinas.
- 11. Galio GALIO PROPIEDADES El galio pertenece al grupo de elementos PROPIEDADES ATOMICAS metálicos conocido como metales del bloque p que están situados junto a los metaloides o Radio medio 130 pm Electronegatividad 1,81 (Pauling) semimetales en la tabla periódica. Este tipo de Radio atómico (calc) 136 pm (Radio de Bohr) elementos tienden a ser blandos y presentan Radio covalente 126 pm puntos de fusión bajos, propiedades que Radio de van der Waals 187 pm también se pueden atribuir al galio, dado que Estado(s) de oxidación 3 Óxido Anfótero forma parte de este grupo de elementos. 1.ª Energía de ionización 578,8 kJ/mol 2.ª Energía de ionización 1979,3 kJ/mol El estado del galio en su forma natural es 3.ª Energía de ionización 2963 kJ/mol sólido. El galio es un elemento químico de 4.ª Energía de ionización 6180 kJ/mol 5.ª Energía de ionización 9020 kJ/mol aspecto blanco plateado y pertenece al grupo de los metales del bloque p. El número atómico PROPIEDADES FISICAS del galio es 31. El símbolo químico del galio es Estado ordinario Sólido Ga. El punto de fusión del galio es de 302,91 Densidad 5904 kg/m3 Punto de fusión 302,91 K (30 °C) grados Kelvin o de 29,76 grados celsius o Punto de ebullición 2.477 K (2.204 °C) grados centígrados. El punto de ebullición del Entalpía de vaporización 258,7 kJ/mol galio es de 24,7 grados Kelvin o de 2203,85 Entalpía de fusión 5,59 kJ/mol Presión de vapor 9,31 × 10-36 Pa a 302,9 grados celsius o grados centígrados. K
- 12. GALIO APLICACIONES Por su intenso y brillante plateado y la capacidad de mojar superficies de vidrio y porcelana se utiliza en la construcción de espejos. Se emplea para dopar materiales semiconductores y construir dispositivos diversos como transistores. En termómetros de alta temperatura por su bajo punto de fusión. El galio se alea con facilidad con la mayoría de los metales y se usa en aleaciones de bajo punto de fusión. El isótopo Ga-67 se usa en medicina nuclear.