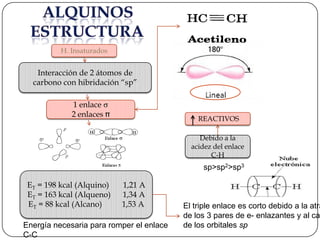
Los alquinos son compuestos insaturados que contienen un triple enlace carbono-carbono. El triple enlace es más corto y más energético que los dobles enlaces, lo que hace que los alquinos sean más reactivos. Los alquinos exhiben propiedades como solubilidad en disolventes orgánicos no polares, puntos de fusión y ebullición más bajos que los alcanos y alquenos, y absorción en el UV-Vis entre 200-800 nm debido a transiciones π-π*.







![LA REACCIÓN DE DIELS-ALDER.
También recibe el nombre de cicloadición [4+2] porque se forma un anillo por la
interacción de cuatro electrones pi del alqueno con dos electrones pi del alqueno o del
alquino.](https://image.slidesharecdn.com/alquinosydienosreloaded-120328160253-phpapp02/85/Alquinos-y-dienos-reloaded-9-320.jpg)


