Elementos y cálculos químicos
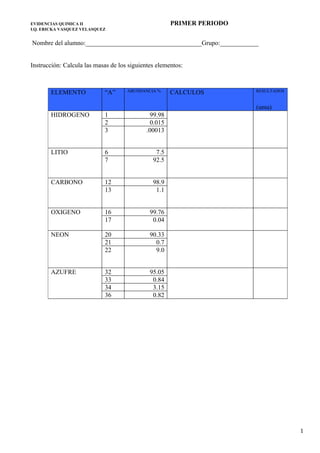
- 1. EVIDENCIAS QUIMICA II PRIMER PERIODO I.Q. ERICKA VASQUEZ VELASQUEZ Nombre del alumno:____________________________________Grupo:____________ Instrucción: Calcula las masas de los siguientes elementos: ELEMENTO “A” ABUNDANCIA % CALCULOS RESULTADOS (uma) HIDROGENO 1 99.98 2 0.015 3 .00013 LITIO 6 7.5 7 92.5 CARBONO 12 98.9 13 1.1 OXIGENO 16 99.76 17 0.04 NEON 20 90.33 21 0.7 22 9.0 AZUFRE 32 95.05 33 0.84 34 3.15 36 0.82 1
- 2. EVIDENCIAS QUIMICA II PRIMER PERIODO I.Q. ERICKA VASQUEZ VELASQUEZ Nombre del alumno:____________________________________Grupo:____________ Compara tus resultados con las masas registradas en tu tabla periódica. Recuerda: La masa de una molécula de una sustancia, expresada en unidades de masa atómica (uma) se llama MASA MOLECULAR INSTRUCCIÓN: Consulta en la tabla periódica y elabora una lista de las masas atómicas de los elementos de la siguiente figura: ABUNDANCIA DE LOS ELEMENTOS EN LA CORTEZA TERRESTRE Aluminio Silicio Otros 7% 13% 1% Oxigeno 34% Hierro 5% Calcio 5% Carbono Sodio 27% 2% Potasio magensio Hidrogeno 2% 2% 2% 2
- 3. EVIDENCIAS QUIMICA II PRIMER PERIODO I.Q. ERICKA VASQUEZ VELASQUEZ Nombre del alumno:____________________________________Grupo:____________ Elemento Masa atómica (uma) 1 2 3 4 5 6 7 8 9 10 INSTRUCCIÓN: Calcula las masas atómicas y molares de los siguientes elementos: Elemento Masa atómica (masa de un Masa molar (masa de 6.02 átomo) uma x1023 Átomos) g/mol Instrucción: Realiza los cálculos necesarios para determinar las masas moleculares que se te piden. Elementos (uma) Moléculas (uma) Oxigeno O2 Cloro Cl2 Nitrógeno N2 hidrogeno H2 Bromo Br2 3
- 4. EVIDENCIAS QUIMICA II PRIMER PERIODO I.Q. ERICKA VASQUEZ VELASQUEZ Nombre del alumno:____________________________________Grupo:____________ Helio He Iodo I2 Recuerda: La unidad de masa atomica (uma) se define como la doceava (1/12) parte de la masa del átomo de carbono 12. Calcula la masa molar de lo que se pide. Elemento o compuesto Cálculos gr/mol CH4 Metano CO Monóxido de carbono C4H10 Butano C12H22O11 Sacarosa O3 Ozono CH3OH Alcohol metilico NH3 Amoniaco C6H12O6 Glucosa 4
- 5. EVIDENCIAS QUIMICA II PRIMER PERIODO I.Q. ERICKA VASQUEZ VELASQUEZ Nombre del alumno:____________________________________Grupo:____________ C27H46O Colesterol CO2 Dióxido de carbono CuSO4 Sulfato de cobre NaCl Sal común KMnO4 Permanganato de potasio KHSO4 Monosulfato acido de potasio NH4OH monohidroxido de amonio Pb(NO3)2 Dinitrato de plomo Al2(SO4)3 Trisulfato de Dialuminio H2SO4 Acido sulfúrico SO2 dioxido de azufre LEY DE CONSERVACION DE MASA 5
- 6. EVIDENCIAS QUIMICA II PRIMER PERIODO I.Q. ERICKA VASQUEZ VELASQUEZ Nombre del alumno:____________________________________Grupo:____________ LEY DE PROPORCIONES CONSTANTES 6
- 7. EVIDENCIAS QUIMICA II PRIMER PERIODO I.Q. ERICKA VASQUEZ VELASQUEZ Nombre del alumno:____________________________________Grupo:____________ LEY DE PROPORCIONES MULTIPLES 7
- 8. EVIDENCIAS QUIMICA II PRIMER PERIODO I.Q. ERICKA VASQUEZ VELASQUEZ Nombre del alumno:____________________________________Grupo:____________ CONVERSIONES MOLARES. Calcula lo siguiente: ¿Cuántos moles contienen...? ¿Cuántos gramos contienen..? a) 300g de PCl3 f) 1.58 moles de CaCO3 b) 150g de CCl4 g) 2 moles de KMnO4 c) 100g de H2O h) 3 moles de AgNO3 d) 280g de NaSO4 i) 1.48 moles de MnO2 e) 350g de CaSO4 j) 6 moles de HCl 8
- 9. EVIDENCIAS QUIMICA II PRIMER PERIODO I.Q. ERICKA VASQUEZ VELASQUEZ Nombre del alumno:____________________________________Grupo:____________ FORMULA MINIMA Y MOLECULAR Determina la fórmula molecular de los siguientes compuestos, partiendo de los datos que se presentan. COMPOSICION FORMULA MINIMA PESO FORMULA MOLECULAR CENTESIMAL MOLECULAR (pon aquí el resultado HgCl 472 g/mol R3= Hg: 1x200.6=200.6 472g/mol/236.05g/mol=1.99 Cl: 1x 35.45=35.45 9 PM=236.05 g/mol Multiplicar por 2la formula mínima. Hg2Cl2 9
- 10. EVIDENCIAS QUIMICA II PRIMER PERIODO I.Q. ERICKA VASQUEZ VELASQUEZ Nombre del alumno:____________________________________Grupo:____________ HO 34 g/mol CH2 84g/mol 10
- 11. EVIDENCIAS QUIMICA II PRIMER PERIODO I.Q. ERICKA VASQUEZ VELASQUEZ Nombre del alumno:____________________________________Grupo:____________ Recuerda: % X = peso del elemento X / peso del compuesto (100) Nota: La suma de la composición % debe aproximarse a 100%. Desarrolla en la parte de atrás el procedimiento para encontrar la fórmula mínima. C= 81.18% EN ESTE CASO NO ESTA DADA 44g/mol H= 18.19% LA FORMULA MINIMA. PERO COLOCA AQUI EL RESULTADO. P=22.54% EN ESTE CASO NO ESTA DADA 137.10 g/mol LA FORMULA MINIMA Cl=77.46% PERO COLOCA AQUI EL RESULTADO. H= 3.06 EN ESTE CASO NO ESTA DADA LA FORMULA MINIMA P=31.56% PERO COLOCA AQUÍ EL O=65.38% RESULTADO. 11
- 12. EVIDENCIAS QUIMICA II PRIMER PERIODO I.Q. ERICKA VASQUEZ VELASQUEZ Nombre del alumno:____________________________________Grupo:____________ Recuerda: % X = peso del elemento X / peso del compuesto (100) Nota: La suma de la composición % debe aproximarse a 100%. Desarrolla en la parte de atrás el procedimiento para encontrar la fórmula mínima. EJERCICIOS PROPUESTOS: 1.- Se tiene una muestra de sulfato ferroso FeSO4 de 1k; calcula el número de moles en la muestra. 2. Calcula el peso de una muestra de Acido Sulfúrico H2SO4 , si sabemos que esta contiene 3.45 moles. 3. ¿ Cuántas moléculas existen en una muestra de 50g de acido clorhídrico HCl?. 12
- 13. EVIDENCIAS QUIMICA II PRIMER PERIODO I.Q. ERICKA VASQUEZ VELASQUEZ Nombre del alumno:____________________________________Grupo:____________ 4. ¿Cuántos átomos de oro, hay en 15g de metal? 5.-Calcula el peso en gramos de 4.5 x1023 átomos de carbono. 6. ¿Cuál será el volumen de 5 moles de O2? 13
- 14. EVIDENCIAS QUIMICA II PRIMER PERIODO I.Q. ERICKA VASQUEZ VELASQUEZ Nombre del alumno:____________________________________Grupo:____________ Problemas propuestos: Problemas mol-mol. 1. ¿Cuántos moles de H2O se obtienen a partir de 3.5 moles de O2 de acuerdo con la siguiente reacción? 2H2 +O2 2H2O 2. ¿Cuántos moles de glucosa C6H12O6 se requieren oxidar para producir 16.5 moles de CO2, de acuerdo con la siguiente reacción? C6H12O6 + 6 O2 6CO2 + 6H2O 2. ¿Cuántas moléculas de amoniaco se producen se producen con 1.5 moles de hidrogeno al reaccionar con nitrógeno, según la siguiente reacción? 3H2 +N2 2NH3 14
- 15. EVIDENCIAS QUIMICA II PRIMER PERIODO I.Q. ERICKA VASQUEZ VELASQUEZ Nombre del alumno:____________________________________Grupo:____________ Calcula el volumen obtenido de NH3 Problemas masa-masa Dada la ecuación: 2PbS + 3O2 2PbO+ 2SO2 Calcular: 1. a) Los gramos que se producen de dióxido de azufre SO2 a partir de 350g de sulfuro de plomo. b). Los gramos requeridos de oxigeno para obtener 600g de monoxido de plomo. 2. Calcula la cantidad de Nitrato de sodio NaNO3 que se puede producir a partir de la reacción de 85 g. de Na2CO3 en la siguiente reacción: Na2CO3 + 2HNO3 2 NaNO3 + H2O + CO2 15
- 16. EVIDENCIAS QUIMICA II PRIMER PERIODO I.Q. ERICKA VASQUEZ VELASQUEZ Nombre del alumno:____________________________________Grupo:____________ Problemas mol-masa. 1. A partir de la siguiente ecuación, calcula lo que se solicita. MnO2 + 4HCl MnCl2 + Cl2 + 2H2O a).¿Cuántos gramos de acido clorhídrico se requieren para obtener 2.5 moles de Cl2 ? b). Al reaccionar 90g. de bioxido de manganeso MnO2, ¿Cuántas moles de agua se producen?. 2. Dada la ecuación: AgNO3 + HCl AgCl + + HNO3 Calcula cuántas moles de Nitrato de plata AgNO3 , precipitan al reaccionar 17.5 g de nitrato de plata con acido clorhidrico HCl? 16