Enlaces
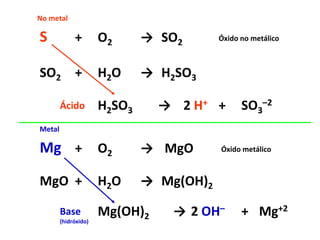
- 1. S SO2 Mg MgO O2 H2O H2SO3 O2 H2O Mg(OH)2 SO2 H2SO3 → MgO Mg(OH)2 → 2 H+ + + + + → → → → + + SO3 –2 Mg+22 OH– Ácido Base (hidróxido) Óxido no metálico Óxido metálico No metal Metal
- 2. PROPIEDADES DE LOS METALES Y NO METALES Metales no metales Tienen un lustre brillante; diversos colores, pero casi todos son plateados. Los sólidos son maleables y dúctiles Buenos conductores del calor y la electricidad Casi todos los óxidos metálicos son sólidos iónicos básicos. Tienden a formar cationes en solución acuosa. Las capas externas contienen poco electrones habitualmente trss o menos. No tienen lustre; diversos colores. Los sólidos suelen ser quebradizos; algunos duros y otros blandos. Malos conductores del calor y la electricidad La mayor parte de los óxidos no metálicos son sustancias moleculares que forman soluciones ácidas Tienden a formar aniones u oxianiones en solución acuosa. Las capas externas contienen cuatro o más electrones*.
- 3. Características metálicas Radio atómico Potencial de ionización y Afinidad electrónica Electronegatividad Propiedades de los elementos (tendencias)
- 5. Radio Atómico R + + - - 1 , 2 21 ssLi 1622 3221 spssNa ... K 162622 433221 spspss
- 6. Potencial de Ionización (PI) Afinidad Electrónica (AE) x x + PI + e x+ x- + e + AE Es la energía necesaria para sacar un ē de un átomo para que se transforme en un ión positivo Es la energía que se desprende cuando un átomo recibe un ē para transformarse en un ión negativo
- 7. Potencial de Ionización (PI) Afinidad Electrónica (AE) PI AE + - + - + - - + x + PI x+ + ē x + AEx¯+ ē
- 8. Electronegatividad E - - + + Es la fuerza de atracción a los electrones de un enlace Mayor poder oxidante cuanto más arriba y a la derecha Menor poder reductor Menor poder oxidante será cuanto más abajo y a la izquierda Mayor poder reductor
- 10. Radio(Å)
- 11. Elementos en la Corteza de la Tierra • Existe un total de 92 elementos que se encuentran de manera natural, tan solo 8 de ellos abundan en las rocas que forman la capa externa de la tierra; la corteza. Juntos, estos ocho elementos, representan el 98.5% de la corteza terrestre. • Los ocho elementos más abundantes en la Corteza terrestre: 46.6% Oxígeno(O) 27.7% Silicón(Si) 8.1% Alumino(Al) 5.0% Hierro(Fe) 3.6% Calcio(Ca) 2.8% Sodio(Na) 2.6% Potasio(K) 2.1% Magnesio(Mg
- 12. Bioelementos. Biomoléculas inorgánicas. Bioelementos. • La materia viva está constituida por unos 70 elementos. Estos elementos se llaman bioelementos o elementos biogénicos. Clasificación de los bioelementos. • Primarios: están formados por C, H, O, N, P y S que constituyen el 99% de la materia viva y son los componentes fundamentales de las biomoléculas. • Pueden formar enlaces covalentes y dar lugar a las biomoléculas que constituirán las estructuras biológicas y llevarán a cabo las funciones vitales. • Poseen un nº atómico bajo, • Como el O y el N son electronegativos, algunas biomoléculas son polares y por ello solubles en agua. • Pueden incorporarse a los seres vivos desde el medio externo (CO2 , H2O, nitratos). • Secundarios:están formados por Na, K, Ca, Mg y Cl. • Oligoelementos:están formados por el Fe, Cu, Zn, Mn, I, Ni y Co (aparecen en la mayoría de los organismos) y Si, F, Cr, Li, B, Mo y Al (sólo están presentes en grupos concretos). Constituyen menos del 0,1% y son esenciales para desempeñar procesos bioquímicos y fisiológicos.
- 13. NOTACION O FORMULA DE LEWIS: • Es la representación convencional de los electrones de valencia (electrones que intervienen en los enlaces químicos), mediante el uso de puntos o aspas que se colocan alrededor del símbolo del elemento. • En general para los elementos representativos tenemos:
- 14. REGLA DEL OCTETO: G.N.Lewis, al estudiar la molécula de hidrógeno (H2) notó que cada átomo al compartir electrones adquiere dos electrones, o sea la estructura electrónica del gas inerte Helio (2He) y comprobó también que los demás átomos que comparten electrones al formar enlace químico, llegan a adquirir la estructura electrónica de los gases nobles. Existen muchas e importantes excepciones a la regla del octeto, por lo tanto no hay que sobrevalorar la importancia ni aplicabilidad de esta regla.
- 15. TIPOS DE ENLACE • ENLACE IONICO Ocurre entre átomos de elementos cuya diferencia de electronegatividades es notable, y su característica principal que existe entre los iones de cargas opuestas (cationes – aniones) que los mantienen juntos en una estructura cristalina. Resulta de la transferencia de uno o mas electrones comúnmente del metal hacia el no metal • Ejemplo: Cloruro de Sodio (NaCl) • SU ELECTRONEGATIVIDAD ES MAYOR A 1.7
- 16. Enlace Metálico Es la menos conocida, ste tipo de enlace solo se realiza entre los átomos de metales, bien entre átomos de un mismo metal o entre átomos de metales diferentes. Dentro de una muestra o pedazo de plata, por ejemplo, los electrones de valencia de todos los átomos se desplazan libres en todas direcciones, quedando los átomos con menos electrones y por ello con más carga positiva o protones en el núcleo. Ejm. Metales y Aleaciones.
- 17. • Enlace covalente • Es la fuerza electromagnética que mantiene unidos a átomos que comparten electrones, los cuales tienen espines o giros opuestos. Los átomos enlazados se encuentran neutros y generalmente son no metálicos. • covalente comparten electrones y se dividen en - -Molécula de cloro (Cl2) • Molécula de Agua (H2O) • Metano (CH4) • Molécula de Oxígeno (O2) • Molécula de Hidrógeno (H2) • Molécula de Flúor (F2) • Amoniaco (NH3) • Trióxido de Azufre (SO3) • Bióxido de Carbono (CO2) • Cloruro de Fósforo (PCl5)
- 18. • Según su polaridad • 1. Enlace Covalente Apolar o Puro: Es cuando los átomos comparten equitativamente a los electrones. Generalmente participan átomo del mismo elemento no metálico. • Se cumple que la diferencia de electronegatividades es cero: ∆EN = 0 • La teoría dice que cuando una molécula presenta geometría simétrica, entonces es apolar. • ejemplo: Hidrogeno (H2), CO2, CH4
- 19. • 2. Enlace Covalente Polar: Es cuando los electrones enlazantes no son compartidos en forma equitativa por los átomos, esto debido a que uno de los átomos es mas negativo que otro. • Se cumple que la diferencia de electronegatividades es diferente de cero: ∆EN ≠ 0 • polar: su electronegatividad oscila entre 0.1 y 1.6 • ejemplo: Yoduro de Hidrógeno HI, SO2