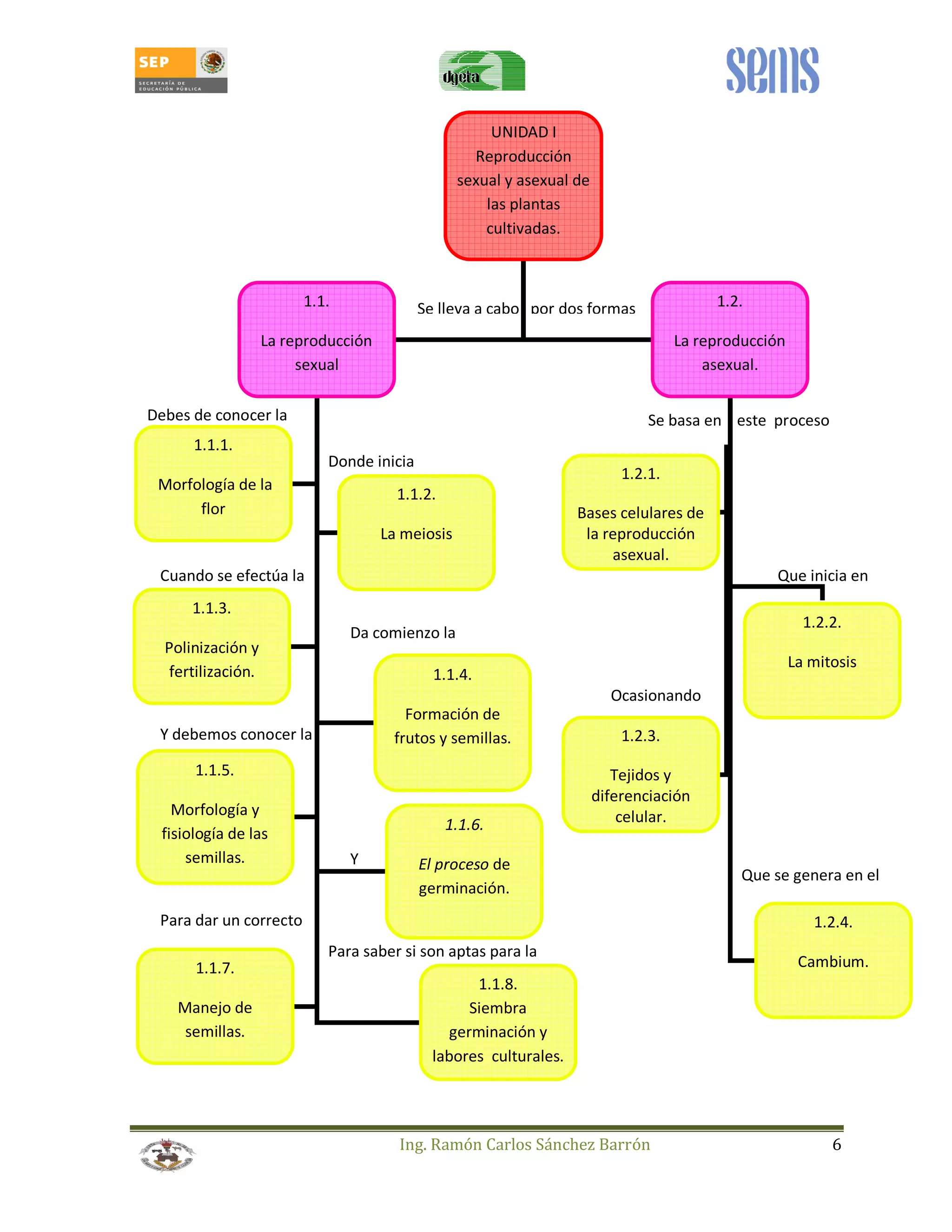
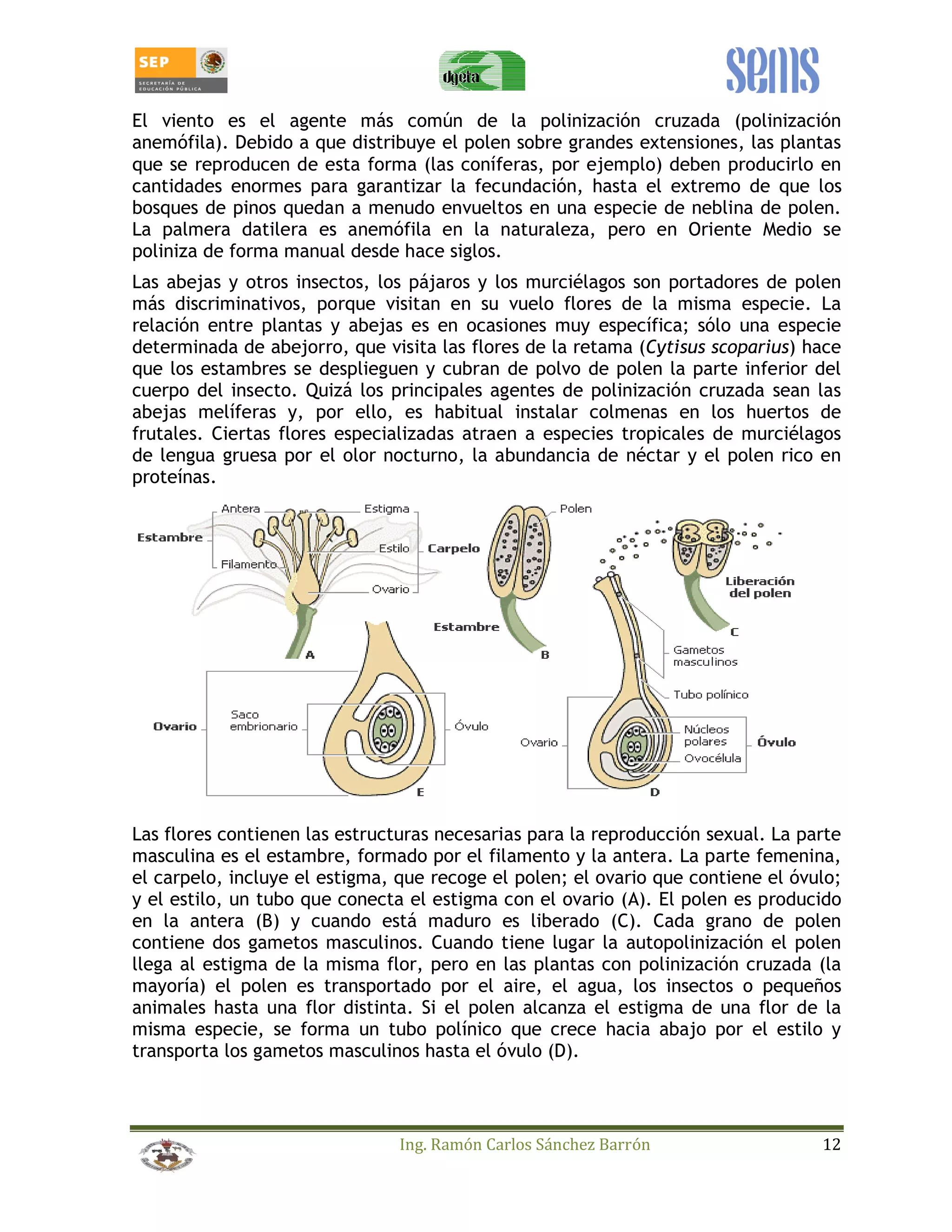
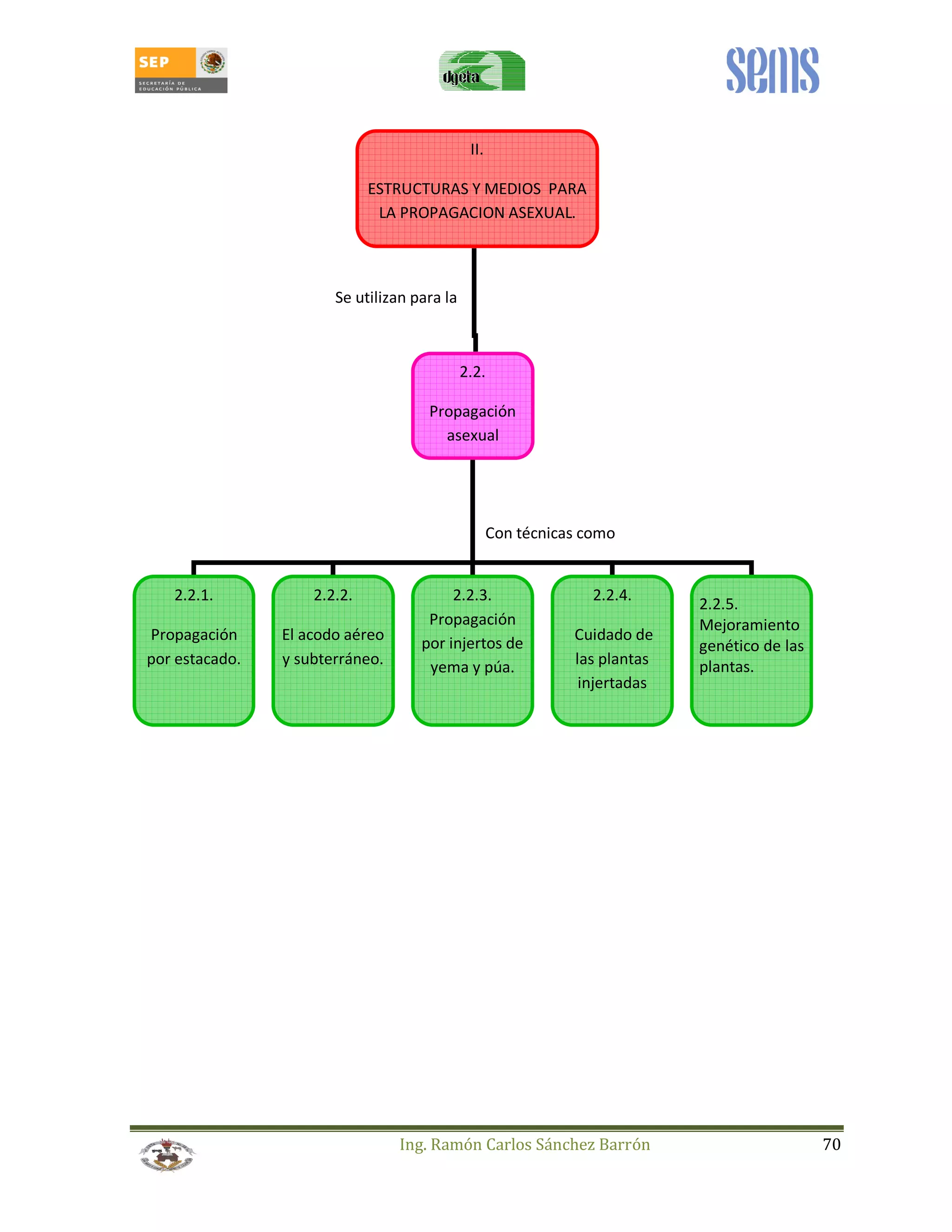
Este manual estudiantil trata sobre la reproducción de plantas a través de métodos sexuales y asexuales. Presenta información sobre la morfología y fisiología de la reproducción sexual en plantas, incluyendo la meiosis, polinización, formación de frutos y semillas, y germinación. También cubre técnicas de reproducción asexual como el estacado, acodo, injertos y el manejo de viveros. El objetivo es enseñar estas técnicas para mejorar la producción agrícola de una manera eficiente y sostenible