Este documento describe los diferentes tipos de enlaces químicos, incluyendo enlaces iónicos, covalentes polares y apolares, y covalentes coordinados. Explica las características de cada tipo de enlace y proporciona ejemplos como NaCl, H2O y NH3. También cubre la notación de Lewis y la representación de electrones de valencia.

![www.RecursosDidacticos.org
Ejemplos :
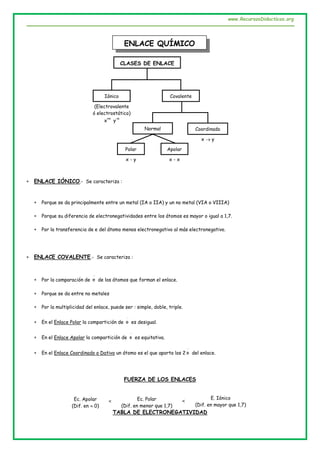
ENLACE IÓNICO :
– Na + [ Na ]
-1
[ ]
-1
EN = 0,9 EN = 30
Dif EN = 3,0 – 0,9 = 2,1 > 1,7
– K +
– Ca +
– Li +
ENLACE COVALENTE
a. Polar :
– H + H Explicación
Cl
xx
xx
xx Cl
xx
xx
x
x
x
I A VII A perdió 1e ganó 1e
F
xx
xx
x
xx
O
xx
xx
x
x
Br
xx
xx
x
xx
Cl
xx
xx
x
xx Cl
xx
xx
x
xx](https://image.slidesharecdn.com/8-200518140132/85/8-enlace-quimico-para-primero-de-secundaria-3-320.jpg)




