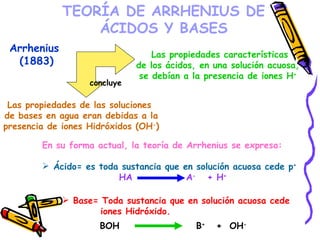
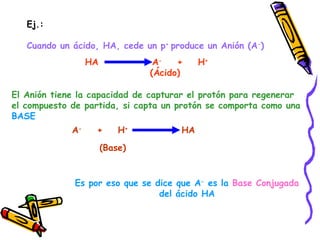
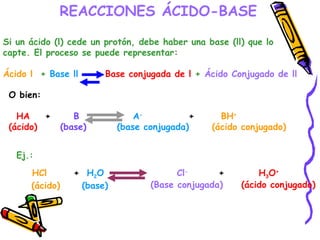
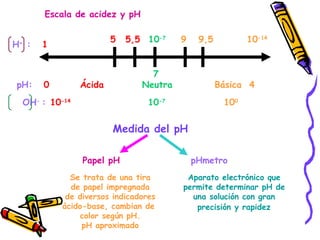
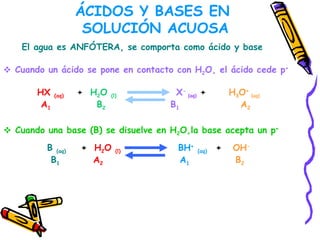
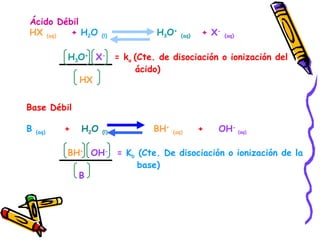
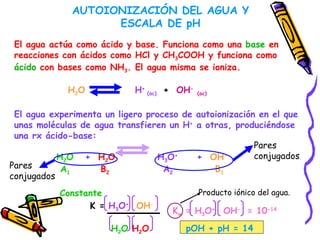
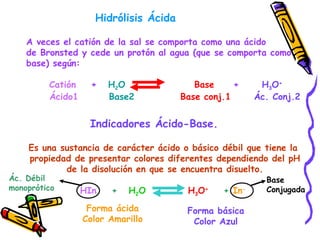
Este documento resume diferentes teorías sobre ácidos y bases. Explica que la teoría de Arrhenius define ácidos como sustancias que ceden iones H+ en agua y bases como sustancias que ceden iones OH-. La teoría de Brønsted-Lowry define ácidos y bases en términos de intercambio de protones. También cubre conceptos como pH, soluciones amortiguadoras, hidrólisis y valoración ácido-base.