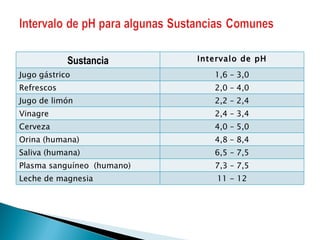
El documento describe las propiedades de los ácidos y bases, incluyendo sus definiciones según las teorías de Arrhenius, Bronsted-Lowry y Lewis. Explica la ionización del agua y los conceptos de pH y pOH para caracterizar soluciones como ácidas, básicas o neutras. También enumera ejemplos de ácidos y bases fuertes.









![donde: K W : producto iónico del agua Así, podemos distinguir tres tipos de disoluciones según las proporciones de los iones procedentes de la ionización del agua: Neutras: [H 3 O + ] = [OH - ] = 10 -7 Ácidas: [H 3 O + ] > 10 -7 y [H 3 O + ] > [OH - ] Básicas: [H 3 O + ] < 10 -7 y [H 3 O + ] < [OH - ] NOTA: [H 3 O + ]=[H + ]](https://image.slidesharecdn.com/cido-baseclase-111112095059-phpapp01/85/TEORIA-DE-ACIDOS-Y-BASES-10-320.jpg)