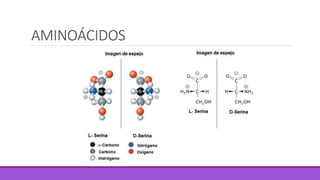
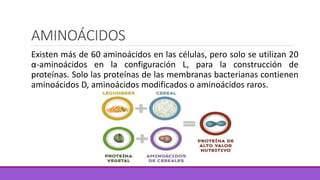
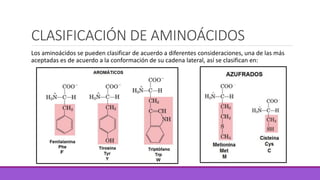
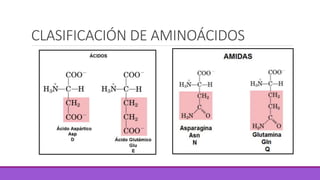
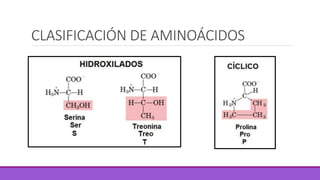
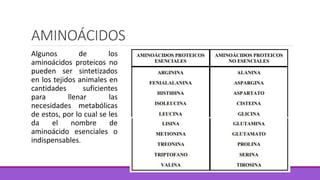
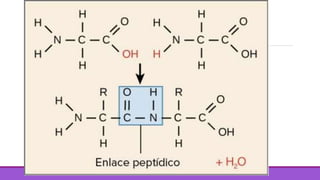
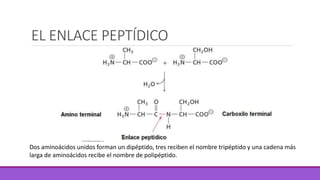
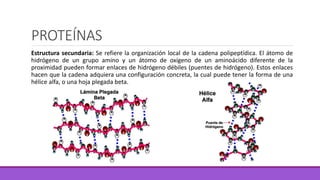
Los aminoácidos son moléculas orgánicas que contienen grupos ácidos y básicos, lo que les permite comportarse como ácidos o bases. Forman enlaces peptídicos para unirse en cadenas que constituyen proteínas, las cuales adoptan estructuras primarias, secundarias, terciarias y cuaternarias. Las proteínas cumplen funciones importantes como la catalítica, regulación, transporte y estructural en los organismos.