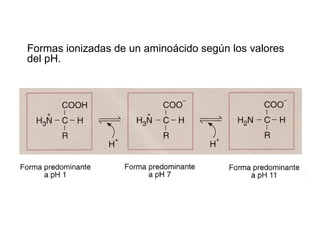
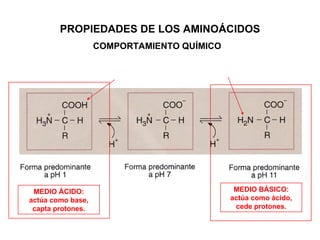
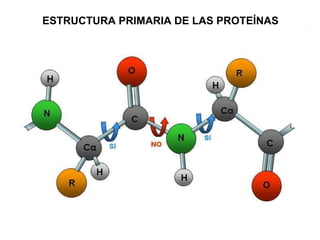
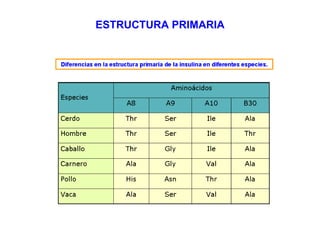
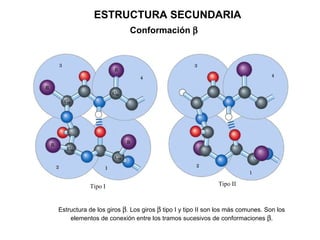
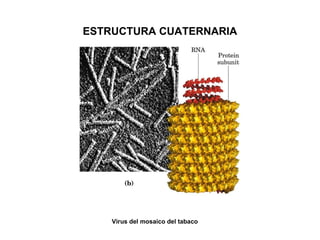
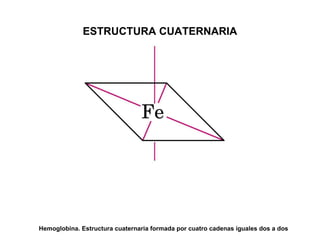
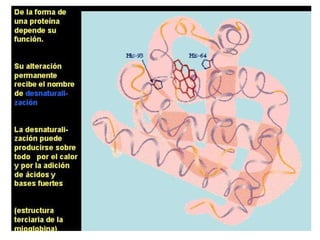
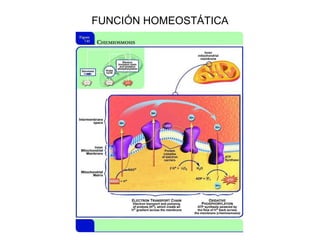
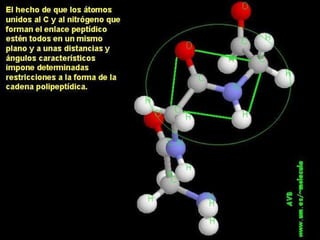
Las proteínas son biomoléculas orgánicas constituidas por aminoácidos unidos por enlaces peptídicos. Pueden clasificarse en holoproteínas y heteroproteínas. Su estructura se organiza en cuatro niveles: estructura primaria dada por la secuencia de aminoácidos; estructura secundaria como hélices alfa o láminas beta; estructura terciaria tridimensional; y estructura cuaternaria en proteínas formadas por varias cadenas polipeptídicas.