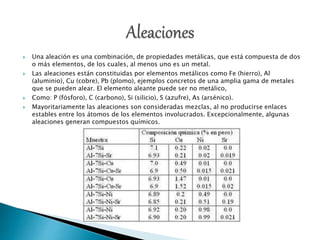
Este documento contiene información sobre diversos temas químicos como átomos, moléculas, oxidación, especies químicas, nomenclatura, aleaciones y más. Explica conceptos como moléculas, estados de oxidación, nomenclatura química, tipos de compuestos como óxidos, anhídridos y peróxidos, e incluye ejemplos de cada uno. También define términos como aleaciones, hidrogenación y balanceo de ecuaciones químicas.