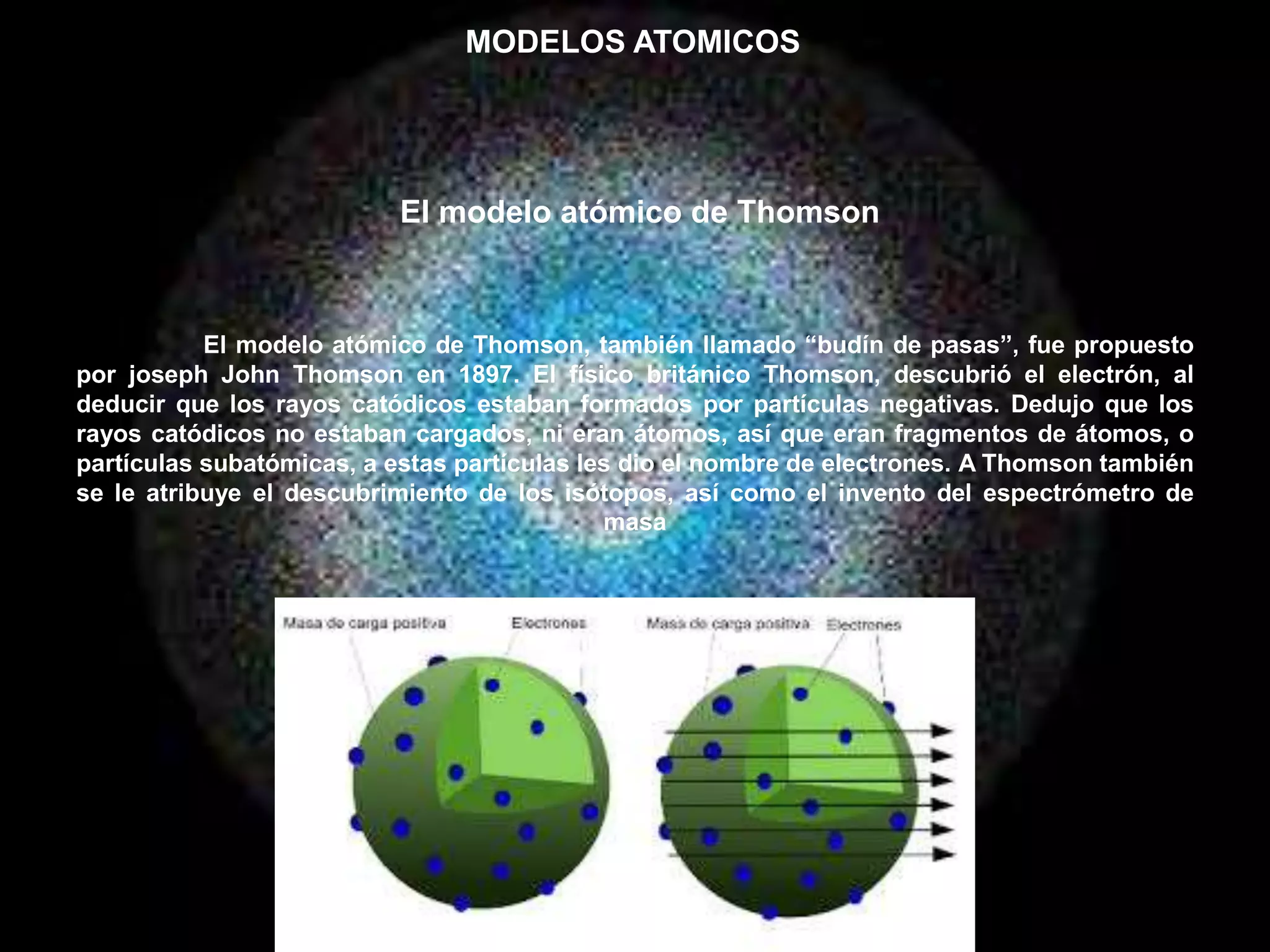
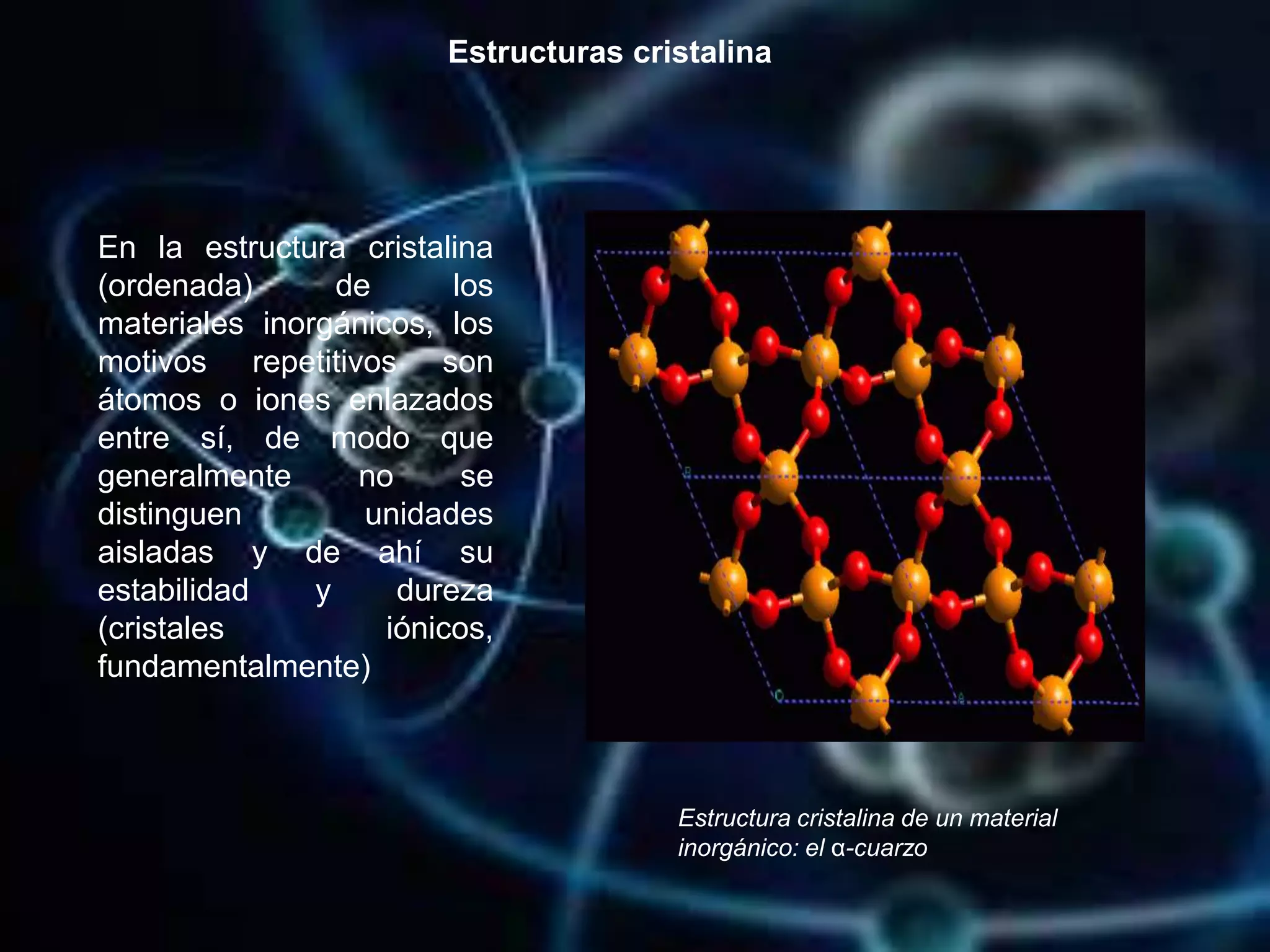
Este documento resume conceptos clave sobre la estructura atómica y cristalina. Explica que los átomos están formados por partículas subatómicas como protones, neutrones y electrones. Luego describe modelos atómicos históricos como los de Dalton, Thomson, Rutherford y Bohr. Finalmente, define la estructura cristalina y explica cómo la organización atómica dentro de la red determina las propiedades de los materiales.