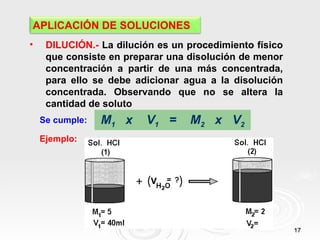
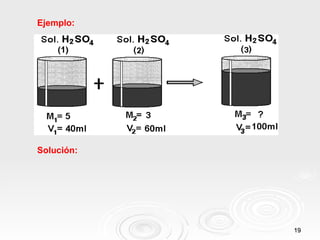
El documento proporciona información sobre soluciones químicas. Define una solución como una mezcla homogénea de dos o más sustancias puras. Explica que un soluto se dispersa en un solvente. También clasifica las soluciones según su estado físico y concentración, y describe cómo calcular la concentración de una solución usando diferentes unidades como la molaridad y normalidad.