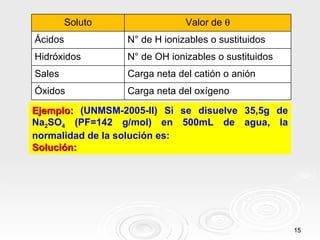
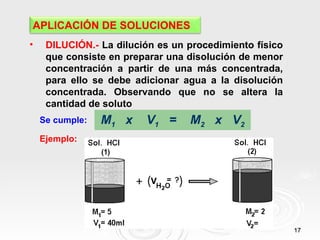
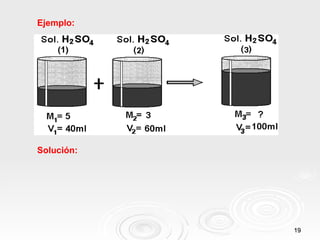
Este documento trata sobre soluciones en química. Explica que una solución es una mezcla homogénea de dos o más sustancias puras. Define los términos soluto, solvente y solución, y describe diferentes tipos de soluciones como soluciones binarias y acuosas. También clasifica las soluciones según su estado físico y concentración, e introduce conceptos como dilución y mezcla de soluciones.