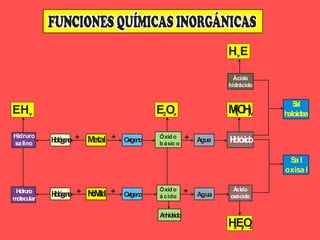
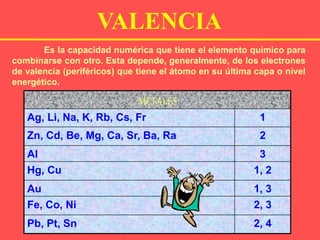
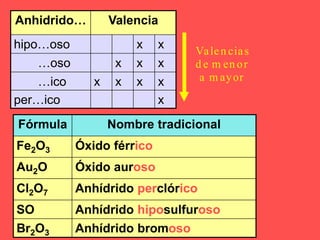
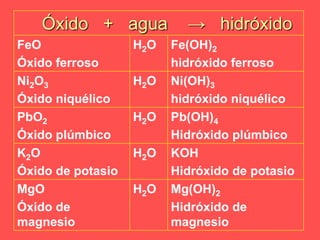
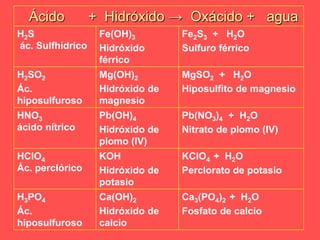
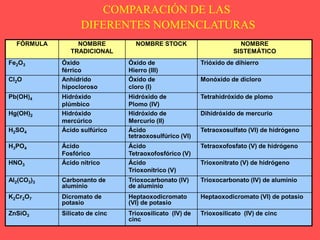
El documento describe las cinco funciones químicas principales de los compuestos inorgánicos: hidruros, óxidos, hidróxidos, ácidos y sales. Explica la formulación y nomenclatura de cada función, incluyendo ejemplos de compuestos representativos. También cubre conceptos como valencia y diferentes sistemas de nomenclatura química.