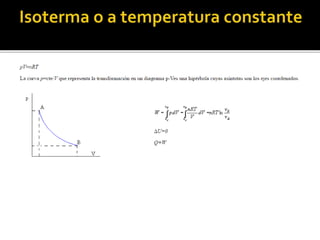
El documento aborda los conceptos básicos de la termodinámica, describiendo los estados de la materia (sólido, líquido y gas) y el estado de equilibrio de un sistema. Se explican las relaciones entre variables como presión, volumen y temperatura a través de la ecuación de estado de un gas ideal, así como la distinción entre calor y energía interna. Además, se discute la primera ley de la termodinámica y cómo se aplica a sistemas de muchas partículas, incluyendo transformaciones a volumen y presión constante.