El documento explica los procedimientos para calcular las concentraciones de iones H+ y OH- en soluciones acuosas de ácidos y bases. Define el pH como el logaritmo negativo de la concentración de H+ e introduce el concepto de pOH. Explica que el pH + pOH = 14 para cualquier solución acuosa y provee ejemplos numéricos para calcular el pH y pOH en diferentes soluciones.
![4.3.3 Procedimientos para el cálculo de [H+] y [OH-], pH y
pOH en soluciones acuosas de ácidos y bases fuertes, y
ácidos y bases débiles.
CÁLCULO DE CONCENTRACIONES AL EQUILIBRIO
En esta sección aplicaremos la constante de equilibrio, la aplicación incluye la
determinación del valor de Ke, la determinación de la concentración de una
especie del lado de reactivos o bien del lado de productos.
Ejemplo 1: Calcula el valor de la constante de equilibrio para la siguiente
reacción si la concentración de A en el equilibrio es 2 molar, la de B es 3.50 M,
la de C es 0.5 M, la de D es 1.5 M.
A + B C +D
107.0
7
75.0
]M50.3][M2[
]M5.1][M25.0[
K
]B][A[
]D][C[
K
===
=
Un valor muy grande de K indica que la reacción se completa o es total hacia la
derecha.
Un valor muy pequeño es indicativo de la tendencia del equilibrio hacia la
izquierda, es decir, existen más reactivos que productos.
Si se trata de un ácido se expresa coma = Ka
Si se trata de una base = Kb
Si se trata de una constante del producto de solubilidad (sales) = Kps](https://image.slidesharecdn.com/constantedeequilibrio-160225025823/85/Constante-de-equilibrio-1-320.jpg)
![Si se trata de una constante de ionización del agua = Kw
Ejemplo 2:
Para la reacción A +B↔ C + D
Existen 1.5 moles A, y 2.25 moles B en un recipiente de un litro y se permite que
alcancen el equilibrio. El valor de la constante de equilibrio es 0.0010 calcular la
concentración de C en el equilibrio.
A + B C +D
M058.0x
M10x375.3x
M10x375.3x
)M375.3)(0010.0(x
M375.3
x
0010.0
]M25.2][m5.1[
]x][x[
0010.0
M25.2B
M5.1A
]B][A[
]D][C[
K
23
232
22
2
2
=
=
=
=
=
=
=
=
=
−
−
PH](https://image.slidesharecdn.com/constantedeequilibrio-160225025823/85/Constante-de-equilibrio-2-320.jpg)
![Definido en 1909,por el químico danés Sorensen como el potencial hidrógeno
(pH) como el logarítmo negativo de la concentración molar (más exactamente de
la actividad molar) de los iones hidrógeno. Esto es:
pH = - log [H+
]
Desde entonces, el término pH ha sido universalmente utilizado por la facilidad de
su uso, evitando asi el manejo de cifras largas y complejas. Por ejemplo, una
concentración de [H+
] = 1×10-7
M (0,0000001) es simplemente un pH de 7 ya que :
pH = -log[10-7
] = 7
El pH típicamente va de 0 a 14, siendo los pH menores que 7 ácidos, y los
mayores, básicos. El pH = 7 indica la neutralidad de la disolución. Se considera
que p es un operador logarítmico sobre la concentración de una solución: p =
-log(...)
También se define el pOH, que mide la concentración de iones OH-
. Puesto que el
agua está disociada en una pequeña extensión en iones OH-
y H+
, tenemos que:
Kw = [H+
][OH-
]=10-14
en donde [H+
] es la concentración de iones de hidrógeno, [OH-
] la de iones
hidróxido, y Kw es una constante conocida como producto iónico del agua.
Por lo tanto,
log Kw = log [H+
] + log [OH-
]
14 = log [H+
] + log [OH-
]
pOH = log [OH-
] = 14 - log [H+
]
Por lo que se puede relacionar directamente el valor del pH con el del pOH.
En disoluciones no acuosas, o fuera de condiciones normales de presión y
temperatura, un pH de 7 puede no ser el neutro. El pH al cual la disolución es
neutra estará relacionado con la constante de disociación del disolvente en el que
se trabaje.](https://image.slidesharecdn.com/constantedeequilibrio-160225025823/85/Constante-de-equilibrio-3-320.jpg)
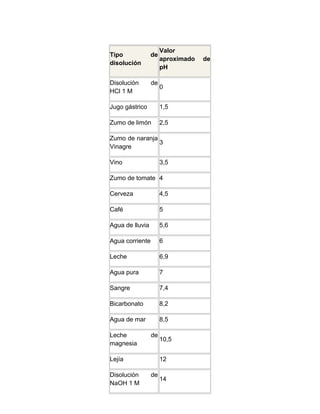
![Para una disolución:
Carácter de la
solución
Rangos de valores para
pH pOH
[H+] > [OH-] Ácida < 7 > 7
[H+] < [OH-] Básica > 7 < 7
[H+] = [OH-] Neutra = 7 = 7
• pOH > 7 : la disolución es ÁCIDA
• pOH = 7 : la disolución es NEUTRA
• pOH < 7 : la disolución es BÁSICA
Otros ejemplos:
Un litro de agua destilada tendrá un carácter NEUTRA y un pH igual a 7
• El pH de la sangre ácida entre 7,35 y 7,45 por lo tanto es una solución
BÁSICA
• Un suelo que tiene un pH superior a 7,50 pero inferior a 9,00 será de
carácter BÁSICO
Medida del pH
El valor del pH se puede medir de forma precisa mediante un pHmetro, un
instrumento que mide la diferencia de potencial entre dos electrodos: un electrodo
de referencia (generalmente de plata/cloruro de plata) y un electrodo de vidrio que
es sensible al ión hidrógeno.](https://image.slidesharecdn.com/constantedeequilibrio-160225025823/85/Constante-de-equilibrio-5-320.jpg)
![También se puede medir de forma aproximada el pH de una disolución empleando
indicadores, ácidos o bases débiles que presentan diferente color según el pH.
Generalmente se emplea papel indicador, que se trata de papel impregnado de
una mezcla de indicadores.
Procedimientos para el cálculo de (H+), pH, (OH-) y pOH en soluciones acuosas
de ácidos y bases fuertes y ácidos y bases débiles.
www.monografìas.com/trabajos13/equiquim/equiquim.shtml
EL pH Y pOH
El concepto de pH (Potencial de Hidrógeno) fue definido por primera vez por
Soren Poer Lauritz Sorensen (1868-1939) Bioquímico danés, originalmente
Sorensen. En el año de 1909.
La escala de pH fue ideada para expresar en forma adecuada diferentes
concentraciones del ión (H+
) (ión Hidrógeno), en varias soluciones sin necesidad
de utilizar números en forma exponencial, debido a que con frecuencia son
números muy pequeños y por lo tanto es difícil trabajar con ellos, fue así entonces
que se decidió trabajar con números enteros positivos.
El pH de una disolución se define como el logaritmo negativo de la concentración
del ión hidrógeno expresado en (mol/litro), la escala de pH se define por la
ecuación:
pH = - log [H+
]
El logaritmo negativo proporciona un número positivo para el pH, además el
termino [H+
] corresponde a la parte numérica de la expresión para la concentración
del ión hidrógeno. Debido a que el pH solo es una manera de expresar la
concentración del ión hidrógeno, las disoluciones ácidas y básicas (25°C), pueden
identificarse por sus valores de pH como sigue:
• Disoluciones acidas: [H+
] > 1,0 x 10-7
M, pH < 7.00
• Disoluciones básicas: [H+
] < 1,0 x 10-7
M, pH > 7.00
• Disoluciones neutras: [H+
] = 1,0 x 10-7
M, pH = 7.00
Se observa que el pH aumenta a medida que el [H+
] disminuye.
En el caso del H2O pura, tendremos:
La disociación del H2O es: H2O + H2O ↔ H3O+
+ OH-](https://image.slidesharecdn.com/constantedeequilibrio-160225025823/85/Constante-de-equilibrio-6-320.jpg)
![Por tanto [H3O+
] = [OH-
] = 1 x 10-7
mol/litro
pH = - log [H3O+
]
pH = - log [1 x 10-7
]
pH = 7
A 25°C, el pH del agua pura y de cualquier solución acuosa que contenga
concentraciones iguales de Ión hidronio y de ión hidroxilo es 7.
Ej. 1: Calcúlese el pH de una solución cuya concentración de ión hidronio es 6,0 x
10 –5
M
pH = - log [6,0 x 10 –5
]
= - log [6,0 x 10 –5
]
= - [log 6,0 + log 10 –5
]
pH = -0,78 + 5 = 4,22
Una escala semejante a la escala del pH puede usarse para expresar la
concentración del ión hidroxilo de las soluciones.
El pOH se define como el logaritmo negativo de la concentración molar de iones
(OH) es decir:
pOH =- log [OH-
]
El pH y el pOH se relacionan así:
[H3O+
] [OH-
]= 10-14
; log [H3O+
] [OH-
]= log 10-14
Luego log [H3O+
] + log [OH-
]= - 14
(- log [H3O+
])+ (- log [OH-
]) = 14
y decir: pH + pOH = 14
Ejemplo 2: Cual es el pH y pOH de una solución 0,0001 M de hidroxido de sodio.
Solución:
El NaoH es un electrolito fuerte, su disociación es : NaoH Na+
+ OH-](https://image.slidesharecdn.com/constantedeequilibrio-160225025823/85/Constante-de-equilibrio-7-320.jpg)
![Hallemos entonces inicialmente el pOH así:
pOH = - log [OH-
]
pOH = - log [1 x 10-4
]
pOH = - [log 1 + log 10-4
]
pOH = - log 1 – (-4) log 10
pOH = 0 – (- 4) log 10
pOH = 0 – (- 4) . 1
pOH = 4
Como la suma del pH y pOH en una solución es igual 14, el pH puede
determinarse, restando de 14 el valor de pOH. En este caso:
pH = 14 – pOH
pH = 14 – 4
pH = 10
R/ El pH de la solución es 10 y el pOH = 4, lo cual indica que la solución es básica
ya que el pH > 7.](https://image.slidesharecdn.com/constantedeequilibrio-160225025823/85/Constante-de-equilibrio-8-320.jpg)