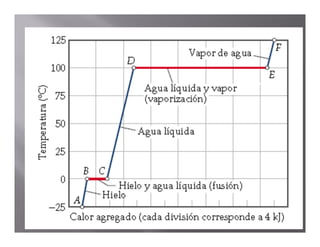
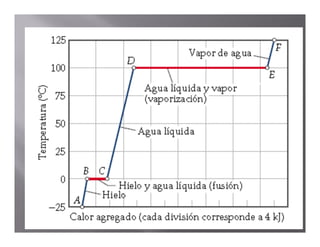
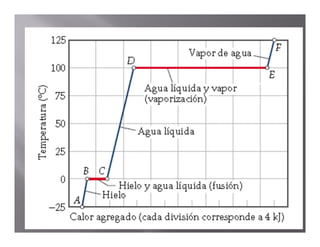
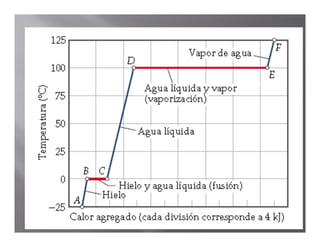
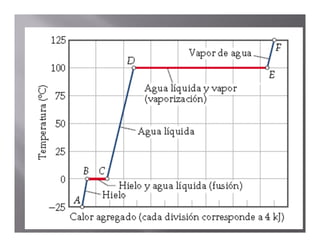
El documento describe el proceso de calentamiento de una muestra de hielo inicialmente a 25°C y 1 atm de presión. Explica que la temperatura aumentará hasta 0°C cuando el hielo comenzará a derretirse, y que la adición de calor se usará para la fusión hasta que todo el hielo se convierta en agua a 0°C. Luego, la temperatura del agua aumentará hasta los 100°C cuando comience la ebullición, y el calor se usará para la vaporización hasta convertir todo el agua en vapor a 100°C.