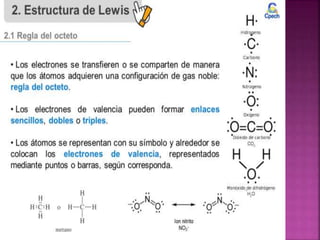
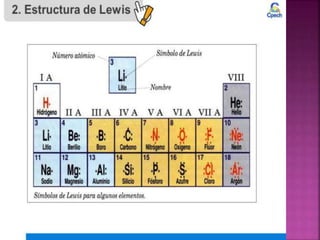
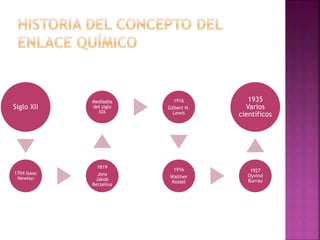
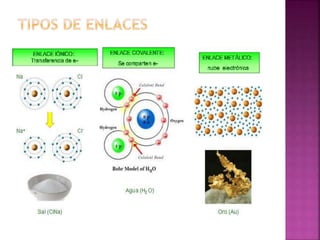
El enlace químico es una interacción entre átomos que les permite formar una unidad estable equivalente a una unidad molecular, formada por un par de electrones compartidos. Los diferentes tipos de enlaces químicos incluyen enlaces iónicos entre metales y no metales, enlaces covalentes entre no metales, y enlaces metálicos característicos de los metales puros. La teoría del octeto de Lewis explica que los átomos tienden a ganar, perder o compartir electrones para alcanzar una configuración electr