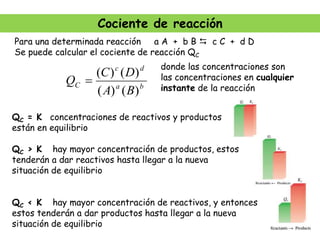
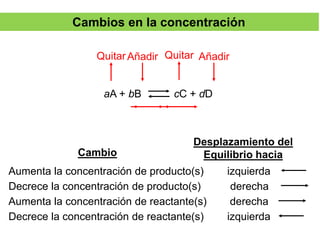
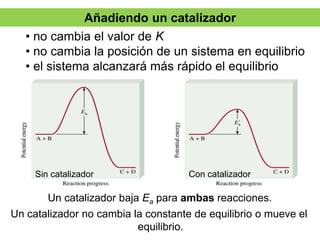
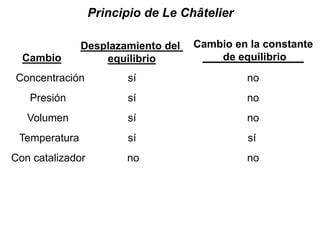
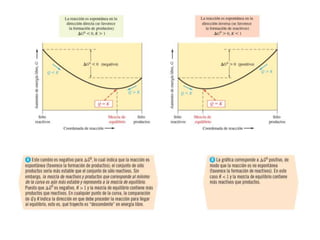
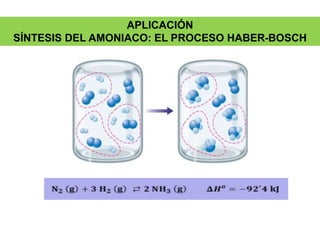
La síntesis del amoniaco se lleva a cabo mediante el proceso Haber-Bosch, el cual involucra la reacción del nitrógeno y el hidrógeno a altas presiones (superiores a 300 atm), temperaturas entre 400-500°C y en presencia de catalizadores metálicos. Este proceso permite obtener amoniaco de manera industrial a partir de los elementos constituyentes del aire y el gas natural, y ha sido fundamental para la producción de fertilizantes sintéticos.






![Para reacciones en fase gaseoso, como la presión es proporcional a la
concentración en un sistema cerrado, la expresión de equilibrio también
puede escribirse así:
Kp =
(PC
c) (PD
d)
(PA
a) (PB
b)
aA + bB cC + dD
Kc =
[C]c[D]d
[A]a[B]b
Relación entre Kc y Kp
A partir de la ley de los gases ideales
Reorganizándola, obtenemos
Conectando esto en la expresión para Kp para cada sustancia, la
relación entre Kc y Kp se vuelve
Kp = Kc (RT)n n = (moles del producto gaseoso) –
- (moles del reactivo gaseoso)
RT
V
n
P
nRT
PV ](https://image.slidesharecdn.com/equilibrioqumico1-231020151856-332fa1b2/85/Equilibrio-quimico1-ppt-10-320.jpg)