Este documento define el equilibrio químico y explica conceptos clave como la constante de equilibrio (Kc) y el cociente de reacción (Q). Un equilibrio químico ocurre cuando las concentraciones de los reactivos y productos permanecen constantes con el tiempo. La constante Kc representa las concentraciones de equilibrio, mientras que Q representa las concentraciones iniciales o en cualquier momento. El sistema evolucionará hacia la derecha si Q < Kc, o hacia la izquierda si Q > Kc, hasta alcanzar el equilibrio cuando





![Variación de la concentración
con el tiempo (H2 + I2 2 HI)
Equilibrio químico
Concentracion
Tiempo (s)
[HI]
[I2]
[H2]](https://image.slidesharecdn.com/equilibrioquimico-101101203232-phpapp02/85/Equilibrio-quimico-6-320.jpg)




![Constante de equilibrio (Kc)
En una reacción cualquiera:
a A + b B c C + d D
[ ] [ ]
[ ] [ ]
c d
c a b
C D
K
A B
×
=
×
Ejemplo: H2(g)+ I2(g) 2 HI (g)
2
2 2
[ ]
[ ] [ ]
c
HI
K
H I
=
×](https://image.slidesharecdn.com/equilibrioquimico-101101203232-phpapp02/85/Equilibrio-quimico-11-320.jpg)
![Ejemplo: Tenemos el equilibrio:
2 SO2(g) + O2(g) 2 SO3(g)
Concentr. iniciales
(mol/l)
Concentr. equilibrio
(mol/l)
[SO2
] [O2
] [SO3
] [SO2
] [O2
] [SO3
] Kc
Exp 1 0,20 0,20 — 0,030 0,115 0,170 279,2
Exp 2 0,15 0,40 — 0,014 0,332 0,135 280,7
Exp 3 — — 0,20 0,053 0,026 0,143 280,0
Exp 4 — — 0,70 0,132 0,066 0,568 280,5
Exp 5 0,15 0,40 0,25 0,037 0,343 0,363 280,6
2
3
2
2 2
[ ]
[ ] [ ]
C
SO
K
SO O
=
×](https://image.slidesharecdn.com/equilibrioquimico-101101203232-phpapp02/85/Equilibrio-quimico-12-320.jpg)

![K >> 1
K << 1
a la derecha Favorece a los productos
a la izquierda Favorece a los reactivos
La reacción se desplaza:
N2O4 (g) 2NO2 (g)
= 4.63 x 10-3
K =
[NH3]2
[N2] [H2]3
Favorece al reactivo
N2(g) + 3H2(g) 2NH3(g)
K =
[NO2]2
[N2O4]
= 4,1X10
8
Favorece al producto
Ejemplos a 25 °C:](https://image.slidesharecdn.com/equilibrioquimico-101101203232-phpapp02/85/Equilibrio-quimico-14-320.jpg)

![Equilibrio homogéneo
Se presenta en una reacción en que todas las especies
reactivas están en la misma fase.
N2O4 (g) 2NO2 (g) Kc =
[NO2]2
[N2O4]](https://image.slidesharecdn.com/equilibrioquimico-101101203232-phpapp02/85/Equilibrio-quimico-16-320.jpg)

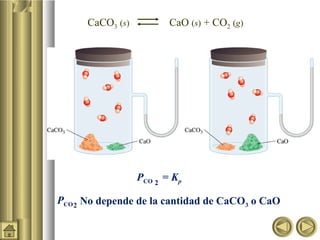
![Equilibrio heterogéneo
Se manifiesta cuando en una reacción los reactivos y productos
están en diferentes fases .
CaCO3 (s) CaO (s) + CO2 (g)
Kc =‘
[CaO][CO2]
[CaCO3]
[CaCO3] = constante
[CaO] = constante
= Kc = [CO2]Kc x‘
[CaCO3]
[CaO]
La concentración de sólidos y líquidos puros no son
incluidos en la expresión para la constante de equilibrio.](https://image.slidesharecdn.com/equilibrioquimico-101101203232-phpapp02/85/Equilibrio-quimico-18-320.jpg)

![Cociente de reacción (Q)
En una reacción cualquiera:
a A + b B c C + d D
se llama cociente de reacción a:
Tiene la misma fórmula que la Kc pero a
diferencia que las concentraciones no tienen por
qué ser las del equilibrio.
[ ] [ ]
[ ] [ ]
×
=
×
c d
a b
C D
Q
A B](https://image.slidesharecdn.com/equilibrioquimico-101101203232-phpapp02/85/Equilibrio-quimico-21-320.jpg)
![Cociente de reacción (Q)
Si Q = Kc entonces el sistema está en
equilibrio.
[ ] [ ]
[ ] [ ]
×
=
×
c d
a b
C D
Q
A B
= Kc](https://image.slidesharecdn.com/equilibrioquimico-101101203232-phpapp02/85/Equilibrio-quimico-22-320.jpg)
![Cociente de reacción (Q)
Si Q < Kc el sistema evolucionará hacia la derecha,
es decir, aumentarán las concentraciones de los
productos y disminuirán las de los reactivos hasta
que Q se iguale con Kc.
[ ] [ ]
[ ] [ ]
×
=
×
c d
a b
C D
Q
A B
< Kc](https://image.slidesharecdn.com/equilibrioquimico-101101203232-phpapp02/85/Equilibrio-quimico-23-320.jpg)
![Cociente de reacción (Q)
Si Q > Kc el sistema evolucionará hacia la izquierda,
es decir, aumentarán las concentraciones de los
reactivos y disminuirán las de los productos hasta
que Q se iguale con Kc.
[ ] [ ]
[ ] [ ]
×
=
×
c d
a b
C D
Q
A B
> Kc](https://image.slidesharecdn.com/equilibrioquimico-101101203232-phpapp02/85/Equilibrio-quimico-24-320.jpg)
![Ejemplo: En un recipiente de 3 litros se introducen
0,6 moles de HI, 0,3 moles de H2 y 0,3 moles de I2
a 490ºC. Si Kc = 0,022 a 490ºC para
2 HI(g) H2(g) + I2(g)
¿se encuentra en equilibrio el sistema?
[H2] · [I2] 0,3/3 · 0,3/3
Q = —————— = —————— = 0,25
[HI]2
(0,6/3)2
Como Q > Kc el sistemael sistemano se encuentrano se encuentraenen
equilibrioequilibrio y la reacción se desplazará hacia
la izquierda.](https://image.slidesharecdn.com/equilibrioquimico-101101203232-phpapp02/85/Equilibrio-quimico-25-320.jpg)
![Ejemplo:A temperatura muy elevada, Kc = 1,0 x 10-13
para la
siguiente reacción.
A un tiempo determinado se detectaron las siguientes
concentraciones: [HF] = 0,600 M, [H2] = 1,50 x 10-3
M y
[F2] = 5,20 x 10-3
M
¿El sistema está en equilibrio? Si no es así, ¿qué debe suceder
para que se establezca el equilibrio?](https://image.slidesharecdn.com/equilibrioquimico-101101203232-phpapp02/85/Equilibrio-quimico-26-320.jpg)



