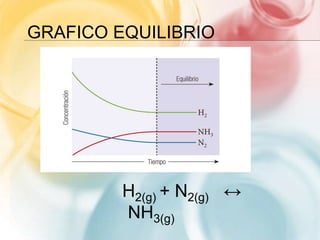
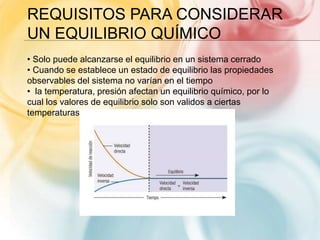
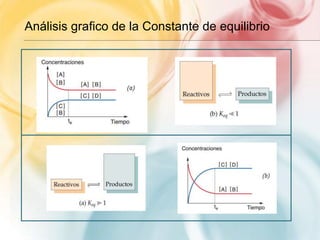
Este documento trata sobre equilibrio químico. Explica que las reacciones reversibles son aquellas donde la transformación de productos a reactantes es parcial, mientras que en las irreversibles es total. Define el equilibrio químico como un estado donde la velocidad de la reacción directa e inversa se igualan. Presenta la expresión matemática del equilibrio y cómo la constante de equilibrio indica hacia dónde se desplaza la reacción.