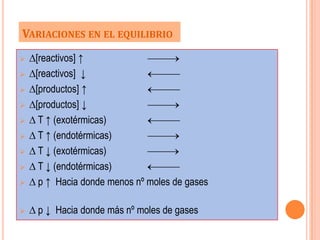
Este documento describe el concepto de equilibrio químico y sus características. Explica que el equilibrio químico ocurre cuando las velocidades de la reacción directa e inversa son iguales, resultando en concentraciones constantes de los reactivos y productos. También define la constante de equilibrio y cómo se ve afectado el equilibrio por cambios en la concentración, presión y temperatura según el principio de Le Chatelier.







![Cuando VD = VIse dice que el sistema alcanza el equilibrio, por lo tanto las propiedades macroscópicas como la temperatura, concentración, densidad, presión, etc. permanecen constante.Concentraciones (mol/l)Equilibrio químico[HI][I2][H2]Tiempo (s)Variación de la concentración con el tiempo](https://image.slidesharecdn.com/equilibrioqumicoclase-111017194901-phpapp02/85/EQUILIBRIO-QUIMICO-8-320.jpg)

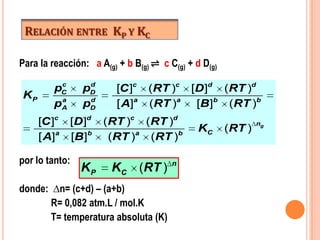

![El equilibrio conserva sus propiedades y la naturaleza de las sustancias en cualquier sentidoConstante de equilibrio (KC)La constante de equilibrio es la relación que se establece entre las concentraciones de reactivos y productos cuando se alcanza el estado de equilibrio.Deducimos su expresión:Sea la siguiente reacción reversiblea A(g) + b B(g) ⇌ c C(g) + d D(g)Si tiene lugar mediante un mecanismo de un solo pasoVD= KD[A]a[B]b y VI= KI[C]c[D]dEn el equilibrio: VD= VIigualando se tiene :](https://image.slidesharecdn.com/equilibrioqumicoclase-111017194901-phpapp02/85/EQUILIBRIO-QUIMICO-12-320.jpg)