Estructuras de Lewis
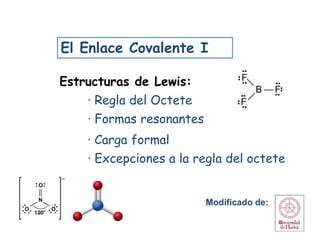
- 1. El Enlace Covalente I Estructuras de Lewis: · Regla del Octete · Formas resonantes · Carga formal · Excepciones a la regla del octete 1 Modificado de: B F F F
- 2. Los gases nobles presentan gran estabilidad química, y existen como moléculas mono-atómicas. Estructuras de Lewis e- de valencia He 2 Ne 8 Ar 8 Kr 8 Xe 8 Rn 8 Su configuración electrónica es muy estable y contiene 8 e- en la capa de valencia (excepto el He). La idea de enlace covalente fue sugerida en 1916 por G. N. Lewis: Los átomos pueden adquirir estructura de gas noble compartiendo electrones para formar un enlace de pares de electrones. G. N. Lewis 2
- 3. Estructuras de Lewis Molécula de Hidrógeno: H2 Tipos de enlaces covalentes: 3
- 4. Estructuras de Lewis Enlace covalente vs Enlace iónico 4
- 5. Estructuras de Lewis En el enlace sólo participan los electrones de valencia (los que se encuentran alojados en la última capa). Ej.: El enlace en la molécula de agua. 5
- 6. Estructuras de Lewis X Símbolos de Lewis: Son una representación gráfica para comprender donde están los electrones en un átomo o molécula, colocando los electrones de valencia como puntos alrededor del símbolo del elemento: v v 6
- 7. Estructuras de Lewis Los átomos se unen compartiendo electrones hasta conseguir completar la última capa con 8 e- (4 pares de e-) es decir conseguir la configuración de gas noble: s2p6 Tipos de pares de electrones: 1- Pares de e- compartidos entre dos átomos (representado con una línea entre los átomos. unidos) · enlaces sencillos · enlaces dobles · enlaces triples 2- Pares de e- no compartidos (ó par solitario) H H O O N N 7 Regla del octeto:
- 8. Estructuras de Lewis¿Como se dibujan las estructuras de Lewis? 1. nº de electrones necesarios para que todos los elementos adopten estructura de gas noble. 2. nº de electrones disponibles (suma de los e- de valencia de los átomos presentes en la molécula) Para un anión se le añade un e- más por cada carga negativa y para un catión se restan tantos electrones como cargas positivas. 3. nº electrones compartidos: los necesarios menos los disponibles (/2 =nº enlaces) 4. nº electrones no compartidos 5. Estructura esquemática con los símbolos de los átomos 6. distribuir los e- colocando los enlaces y los pares no compartidos necesarios, de forma que se complete un octete para cada átomo 8
- 9. Estructuras de Lewis¿Como se dibujan las estructuras de Lewis? 9 5. Estructura esquemática con los símbolos de los átomos: (en los oxoácidos o sus inones) - El átomo central en el centro… (el menos electronegativo) - Los oxígenos unidos directamente al átomo central (rodeándolo) - Los hidrógenos siempre unidos a los oxígenos Átomos de oxígeno. Algunas normas: - Si dan un solo enlace sencillo debe ser dativo - Si están unidos a un hidrógenos siempre darán dos enlaces sencillos (uno al H y otro al átomo central) - Si dan un doble enlace les quedaran dos pares no compartidos Ejemplo en YouTube
- 10. Estructuras de LewisEstructuras de Lewis Ejemplo 1: CH4 e- necesarios: 8 + 4x2= 16 e- disponibles: 8 C: 1s22s2p2 4e- H: 1s1 1e- x4= 4e- e- compartidos: 16-8= 8 , 4 pares, 4 enlaces e- no compartidos 8-8=0 C H H HH Ejemplo 2: H2CO C: 1s22s2p2 4e- H: 1s1 1e- x2= 2e- O: 1s22s2p4 6e- e- compartidos: 20-12= 8, 4 pares, 4 enlaces e- no compartidos 12-8= 4 , 2 pares H H C O 10 e- necesarios: 8 + 8+ 2x2= 20 e- disponibles: 4+6+2=12
- 11. Estructuras de Lewis Ejemplo 3: SiO4 -4 Ejemplo 4: SO2 11 S O O e- necesarios: 8 + 2x8 = 24 e- disponibles: 6 + 2x6 =18 e- compartidos: 24-18= 6, 3 pares comp 3 enlaces e- no compartidos 18-6= 12 , 6 pares Si O O OO 4- e- compartidos: 40-32 = 8, 4 pares comp 4 enlaces e- no compartidos 32- 8= 24 , 12 pares e- necesarios: 8 + 4x8 = 40 e- disponibles: 4 + 4x6 + 4 =32
- 12. Estructuras de Lewis En ciertas ocasiones la estructura de Lewis no describe correctamente las propiedades de la molécula que representa. Ejemplo: Experimentalmente el ozono tiene dos enlaces idénticos mientras que en la estructura de Lewis aparecen uno doble (+ corto) y uno sencillo (+ largo). O O O 12 Formas Resonantes
- 13. Estructuras de Lewis O O O O O O Explicación: RESONANCIA Suponer que los enlaces son promedios de las posibles situaciones Formas resonantes - No son diferentes tipos de moléculas, solo hay un tipo. - Las estructuras son equivalentes. - Sólo difieren en la distribución de los electrones, no de los átomos. or Ejemplos comunes: O3, NO3 -, SO4 2-, NO2, y benceno. 13
- 14. Estructuras de Lewis Excepciones a la regla del Octeto Hay tres clases de excepciones a la regla del Octete: a) Moléculas con nº de e- impar. N O NO (5+6=11 e- de valencia) Otros ejemplos: ClO2, NO2 b) Moléculas en las cuales un átomo tiene menos de un octete. BF3 (3+7x3= 24 e- de valencia). B F F F Ej: Compuestos de los grupos 1A, 2A y 3A. 14
- 15. Estructuras de Lewis c)Moléculas en las cuales un átomo tiene más de un octete. La clase más amplia de moléculas que violan la regla consiste en especies en las que el átomo central está rodeado por mas de 4 pares de e-, tienen octetes expandidos. PCl5 XeF4 nº de e- de v 5+7x5= 40 e- P Cl Cl Cl Cl Cl nº de e- de v 8+7x4= 36 e- Xe F F F F Todos estos átomos tienen orbitales d disponibles para el enlace (3d, 4d, 5d), donde se alojan los pares de e- extras. 15 SF6
- 16. Estructuras de LewisCarga Formal La carga formal es la diferencia entre el nº de e- de valencia y el nº de e- asignado en la estructura de Lewis (los e- no compartidos y la mitad de los e- compartidos). Cf = X – (Y + Z/2) X= nº de e- de valencia Y= nº de e- no compartidos Z= nº de e- compartidos • La Cf total de la molécula sea más próxima a 0 • Las Cf negativas deben estar localizadas sobre los átomos + electronegativo • Cf del átomo central sea cero Cuando sea posible escribir más de una estructura para la misma molécula, la estructura de Lewis más correcta cumplirá: Reglas de la Carga Formal
- 17. Estructuras de Lewis C OH H H H I) - Para C: Cf= 4-(0+8/2)= 0 - Para O: Cf= 6-(4+4/2)= 0 II) HH OC H H - Para C: Cf= 4-(2+6/2)= -1 - Para O: Cf= 6-(2+6/2)= +1 Correcta! Esto permite explicar algunas de las excepciones a la regla del octeto en los átomos del periodo 3 (o superior), que tienen orbitales 3d en los que alojar más de 8 electrones en su última capa. A continuación están las estructuras correctas para esas moléculas, aplicando las reglas de la carga formal, puedes comprobar que no son las que te saldrían inicialmente
