Formación de compuestos inorgánicos .pptx
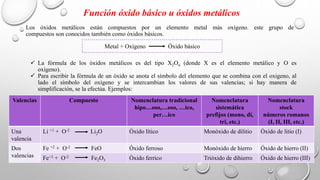
- 1. Los óxidos metálicos están compuestos por un elemento metal más oxígeno. este grupo de compuestos son conocidos también como óxidos básicos. Valencias Compuesto Nomenclatura tradicional hipo…oso,…oso, …ico, per…ico Nomenclatura sistemática prefijos (mono, di, tri, etc.) Nomenclatura stock números romanos (I, II, III, etc.) Una valencia Li +1 + O-2 Li2O Óxido lítico Monóxido de dilitio Óxido de litio (I) Dos valencias Fe +2 + O-2 FeO Óxido ferroso Monóxido de hierro Óxido de hierro (II) Fe+3 + O-2 Fe2O3 Óxido ferrico Trióxido de dihierro Óxido de hierro (III) Función óxido básico u óxidos metálicos Metal + Oxígeno Óxido básico La fórmula de los óxidos metálicos es del tipo X2On (donde X es el elemento metálico y O es oxígeno). Para escribir la fórmula de un óxido se anota el símbolo del elemento que se combina con el oxigeno, al lado el símbolo del oxígeno y se intercambian los valores de sus valencias; si hay manera de simplificación, se la efectúa. Ejemplos:
- 2. Valencias Compuesto Nomenclatura tradicional hipo…oso,…oso, …ico, per…ico Nomenclatura sistemática prefijos (mono, di, tri, etc.) Nomenclatura stock números romanos (I, II, III, etc.) Tres valencias Cr+2 + O-2 CrO Óxido hipocromoso Monóxido de cromo Óxido de cromo (II) Cr+3 + O-2 Cr2O3 Óxido cromoso Trióxido de dicromo Óxido de cromo (III) Cr+6 + O-2 CrO3 Óxido crómico Trióxido de cromo Óxido de cromo (VII) Cuatro valencias Mn+2 + O-2 MnO Óxido hipomanganoso Monóxido de manganeso Oxido de manganeso (II) Mn+3 + O-2 Mn2O3 Óxido manganoso Trióxido de dimanganeso Oxido de manganeso (III) Mn+4 + O-2 MnO2 Óxido mangánico Dióxido de manganeso Oxido de manganeso (IV) Mn+7 + O-2 Mn2O7 Óxido permangánico Heptaóxido de demanganeso Oxido de manganeso (VII) De manera general para escribir la fórmula de los compuestos se ha acordado escribir los símbolos de los elementos que componen el compuesto en orden de su electronegatividad: el menos electronegativo a la izquierda y el más electronegativo a la derecha.
- 3. Función óxido ácido (anhídridos ácidos) En los óxidos ácidos, el oxígeno se combina con un no metal. El oxígeno actúa con número de oxidación -2 y el otro elemento con número de oxidación positivo. No metal + Oxígeno Óxido ácido (anhídridos) La fórmula de los anhídridos es del tipo X2On (donde X es un elemento no metálico y O es oxígeno). Para formular los óxidos escribimos el símbolo del no metal seguido del símbolo del oxígeno y se intercambian las valencias, en este caso el no metal ocupa sus covalencias. Ejemplos: Valencias Compuesto Nomenclatura tradicional, hipo…oso,…oso, …ico, per…ico Nomenclatura sistemática prefijos (mono, di, tri, etc.) Nomenclatura stock números romanos (I, II, III, etc.) Una Valencia Si+4 + O-2 SiO2 Anhídrido silícico Dióxido de silicio Óxido de silico (IV) Dos valencias C+2 + O-2 CO Anhídrido carbonoso Monóxido de carbono Óxido de carbono (II) C+4 + O-2 CO2 Anhídrido carbónico Dióxido de carbono Óxido de carbono (IV)
- 4. Nomenclatura tradicional: el nombre genérico es anhídrido y el específico el del no metal. Para ello se debe de tener en cuenta la valencia del elemento no metálico. Valencias Compuesto Nomenclatura tradicional, hipo…oso,…oso, …ico, per…ico Nomenclatura sistemática prefijos (mono, di, tri, etc.) Nomenclatura stock números romanos (I, II, III, etc.) Tres valencias S+2 + O-2 SO Anhídrido hiposulfuroso Monóxido de azufre Óxido de azufre (II) S+4 + O-2 SO2 Anhídrido sulfuroso Dióxido de azufre Óxido de azufre (IV) S+6 + O-2 SO3 Anhídrido sulfúrico Trióxido de azufre Óxido de azufre (VI) Cuatro valencias Cl+l + O-2 Cl2O Anhídrido hipocloroso Monóxido de dicloro Óxido de cloro (I) Cl+3 + O-2 Cl2O3 Anhídrido cloroso Trióxido de dicloro Óxido de cloro (III) Cl+5 + O-2 Cl2O5 Anhídrido clórico Pentaóxido de dicloro Óxido de cloro (V) Cl+7 + O-2 Cl2O7 Anhídrido perclórico Heptaóxido de dicloro Óxido de cloro (VII)
- 5. Peróxidos Los peróxidos consisten en combinaciones binarias del oxígeno junto a ciertos metales. Son derivados de óxidos que contienen la agrupación -O-O-, O2 2- llamado ión peróxido. Óxido básico + Oxígeno Peróxido La fórmula de los peróxidos es del tipo X2(O2)n (donde X es el elemento metálico, O es oxígeno y n es la valencia del elemento metálico). Escribir el símbolo del metal y luego el grupo peróxido. Escribir la valencia tanto del metal como del grupo peróxido. Intercambiar valencias. Ejemplos: Valencias Compuesto Nomenclatura tradicional, hipo…oso,…oso, …ico, per…ico Nomenclatura sistemática prefijos (mono, di, tri, etc.) Nomenclatura stock números romanos (I, II, III, etc.) Una valencia Li+1 + O2 -2 Li2O2 Peróxido lítico Peróxido de dilitio Peróxido de litio (I) Dos valencias Cu+1 + O2 -2 Cu2O2 Peróxido cuproso Peróxido de dicobre Peróxido de cobre (I) Cu+2 + O2 -2 Cu2(O2)2 Peróxido cúprico Diperóxido de dicobre Peróxido de cobre (II)
- 6. Nomenclatura tradicional: la nomenclatura tradicional de los peróxidos se nombra con la palabra peróxido seguida del elemento metálico teniendo en cuenta la valencia del elemento metálico. Valencias Compuesto Nomenclatura tradicional, hipo…oso,…oso, …ico, per…ico Nomenclatura sistemática prefijos (mono, di, tri, etc.) Nomenclatura stock números romanos (I, II, III, etc.) Tres valencias Li+1 + O2 -2 Li2O2 Peróxido lítico Peróxido de dilitio Peróxido de litio (I) Cu+1 + O2 -2 Cu2O2 Peróxido cuproso Peróxido de dicobre Peróxido de cobre (I) Cu+2 + O2 -2 Cu2(O2)2 CuO2 Peróxido cúprico Peróxido de cobre Peróxido de cobre (II) Cuatro valencias U+3 + O2 -2 U2(O2)3 Peróxido hipouranioso Triperóxido de diuranio Peróxido de uranio (III) U+4 + O2 -2 U2(O2)4 U(O2)2 Peróxido uranioso Diperóxido de uranio Peróxido de uranio (IV) U+5 + O2 -2 U2(O2)5 Peróxido uránico Pentaperóxido de diuranio Peróxido de uranio (V) U+6 + O2 -2 U2(O2)6 U(O2)3 Peróxido peruránico Triperóxido de diuranio Peróxido de uranio (VI)
- 7. Hidruros metálicos Los hidruros metálicos o simplemente hidruros, son combinaciones de hidrógeno junto a un elemento metálico. En este tipo de compuestos los metales actúan con valencias positivas mientras que el hidrógeno actúa con valencia -1. Metal + Hidrogeno Hidruros metálico La fórmula de los hidruros es del tipo XHn (donde X es el elemento metálico, H es el hidrógeno y n es la valencia del elemento metálico). Los hidruros se formulan anteponiendo en primer lugar el metal seguido del hidrógeno siendo intercambiadas sus valencias. Ejemplos: Valencias Compuesto Nomenclatura tradicional, hipo…oso,…oso, …ico, per…ico Nomenclatura sistemática prefijos (mono, di, tri, etc.) Nomenclatura stock números romanos (I, II, III, etc.) Una valencia Li+1 + H-1 LiH Hidruro lítico Monohidruro de litio Hidruro de litio (I) Dos Valencias Co+2 + H-1 CoH2 Hidruro cobaltoso Dihidruro de cobalto Hidruro de cobalto (II) Co+3 + H-1 CoH3 Hidruro cobáltico Trihidruro de cobalto Hidruro de cobalto (III)
- 8. Nomenclatura tradicional: la nomenclatura tradicional de los hidruros metálicos se nombra con la palabra hidruro seguido del elemento metálico teniendo en cuenta la valencia del elemento metálico. Valencias Compuesto Nomenclatura tradicional, hipo…oso,…oso, …ico, per…ico Nomenclatura sistemática prefijos (mono, di, tri, etc.) Nomenclatura stock números romanos (I, II, III, etc.) Tres valencias Ti+2 + H-1 TiH2 Hidruro hipotitanioso Dihidruro de titanio Hidruro de titanio (II) Ti+3 + H-1 TiH3 Hidruro titanioso Trihidruro de titanio Hidruro de titanio (III) Ti+4 + H-1 TiH4 Hidruro titánico Tetrahidruro de titanio Hidruro de titanio (IV) Cuatro valencias V+2 + H-1 VH2 Hidruro hipovanadioso Dihidruro de vanadio Hidruro de vanadio (II) V+3 + H-1 VH3 Hidruro vanadioso Trihidruro de vanadio Hidruro de vanadio (III) V+4 + H-1 VH4 Hidruro vanádico Tetrahidruro de vanadio Hidruro de vanadio (IV) V+5 + H-1 VH5 Hidruro pervanádico Pentahidruro de vanadio Hidruro de vanadio (V)
- 9. Hidruros volátiles Los hidruros volátiles son combinaciones de hidrógeno junto a uno de los siguientes elementos: N, P, As, Sb, C, Si y B. Todos ellos actúan con valencia 3 salvo el C y el si que actúan con valencia 4. Los hidruros volátiles están unidos mediante enlaces covalentes en disolución acuosa por lo que no presentan carácter ácido. No metal + Hidrogeno Hidruros volátiles La fórmula de los hidruros volátiles son del tipo XHn (donde X es el elemento no metálico y n es la valencia de dicho elemento) Los hidruros volátiles se formulan anteponiendo en primer lugar el elemento correspondiente seguido del hidrógeno siendo intercambiadas sus valencias. Ejemplos: Compuesto Nomenclatura tradicional Nomenclatura sistemática prefijos (mono, di, tri, etc.) N+3 + H-1 NH3 Amoniaco Trihidruro de nitrógeno P+3 + H-1 PH3 Fosfina Trihidruro de fósforo As+3 + H-1 AsH3 Arsina Trihidruro de arsénico Sb+3 + H-1 SbH3 Estibina Trihidruro de antimonio B+3 + H-1 BH3 Borano Trihidruro de boro C+4 + H-1 CH4 Metano Tetrahidruro de carbono Si+4 + H-1 SiH4 Silano Tetrahidruro de silicio Los hidruros volátiles se nombran mediante la nomenclatura sistemática o mediante la nomenclatura tradicional que en este tipo de compuestos reciben nombres propios. En este tipo de compuestos no se utiliza la nomenclatura de stock.
- 10. Hidróxidos Los hidróxidos son compuestos iónicos formados por un metal (catión) y un elemento del grupo hidróxido (OH-) (anión). Se trata de compuestos ternarios aunque tanto su formulación y nomenclatura son idénticas a las de los compuestos binarios. Óxido básico + (OH)-1 Hidróxido La fórmula general de los hidróxidos es del tipo X(OH)n , siendo el número de iones igual que el número de oxidación del catión metálico, para que la suma total de las cargas sea cero. Los hidróxidos son nombrados utilizando la nomenclatura tradicional, nomenclatura de stock así como la nomenclatura sistemática. Ejemplos: Valencias Compuesto Nomenclatura tradicional, hipo…oso,…oso, …ico, per…ico Nomenclatura sistemática prefijos (mono, di, tri, etc.) Nomenclatura stock números romanos (I, II, III, etc.) Una valencia Mg+2 + (OH)-1 Mg(OH)2 Hidróxido magnésico Dihidróxido de magnesio Hidróxido de magnesio (II) Dos valencias Pt+2 + (OH)-1 Pt(OH)2 Hidróxido platinoso Dihidróxido de platino Hidróxido de platino (II) Pt+4 + (OH)-1 Pt(OH)4 Hidróxido platínico Tetrahidróxido de platino Hidróxido de platino (IV)
- 11. Nomenclatura tradicional: La nomenclatura tradicional comienza con la palabra hidróxido seguido del elemento teniendo en cuenta la valencia con la que actúa. Valencias Compuesto Nomenclatura tradicional, hipo…oso,…oso, …ico, per…ico Nomenclatura sistemática prefijos (mono, di, tri, etc.) Nomenclatura stock números romanos (I, II, III, etc.) Tres valencias Zr+2 + (OH)-1 Zr(OH)2 Hidróxido hipocirconioso Dihidróxido de circonio Hidróxido de circonio (II) Zr+3 + (OH)-1 Zr(OH)3 Hidróxido circonioso Trihidróxido de circonio Hidróxido de circonio (III) Zr+4 + (OH)-1 Zr(OH)4 Hidróxido circónico Tetrahidróxido de circonio Hidróxido de circonio (IV) Cuatro valencias V+2 + (OH)-1 V(OH)2 Hidróxido hipovanadoso Dihidróxido de vanadio Hidróxido de vanadio (II) V+3 + (OH)-1 V(OH)3 Hidróxido vanadoso Trihidróxido de vanadio Hidróxido de vanadio (III) V+4 + (OH)-1 V(OH)4 Hidróxido vanádico Tetrahidróxido de vanadio Hidróxido de vanadio (IV) V+5 + (OH)-1 V(OH)5 Hidróxido pervanádico Pentahidróxido de vanadio Hidróxido de vanadio (V)
- 12. Ácidos hidrácidos Los hidrácidos también llamados ácidos hidrácidos son combinaciones binarias entre hidrógeno junto a los halógenos (F, Cl, Br, I) exceptuando el As y con los anfígenos (S, Se, Te) exceptuando el O, los primeros actúan con valencia 1 y los segundos actúan con valencia 2. No metal + Hidrógeno Ácidos hidrácidos Las fórmulas de los hidrácidos son del siguiente tipo HnX (donde X es el elemento no metálico y n es la valencia de dicho elemento). Los hidrácidos se nombran utilizando la nomenclatura tradicional y la nomenclatura sistemática, no se utiliza la nomenclatura stock. Ejemplos: Valencias Compuesto Nomenclatura tradicional, ácido…..hídrico Nomenclatura sistemática sufijo (uro) Una valencia Cl+1 + H-1 HCl Ácido clorhídrico Cloruro de hidrógeno Br+1 + H-1 HBr Ácido bromhídrico Bromuro de hidrógeno F+1 + H-1 HF Ácido fluorhídrico Fluoruro de hidrógeno I+1 + H-1 HI Ácido yodhídrico Yoduro de hidrógeno
- 13. Nomenclatura tradicional: en la nomenclatura tradicional los hidrácidos se nombran usando la palabra ácido ya que tienen carácter ácido en disolución acuosa y añadiendo el sufijo hídrico al nombre del elemento no metal. Valencias Compuesto Nomenclatura tradicional, ácido…..hídrico Nomenclatura sistemática sufijo (uro) Dos valencias S+2 + H-1 H2S Ácido sulfhídrico Sulfuro de dihidrógeno Se+2 + H-1 H2Se Ácido selenhídrico Seleniuro de dihidrógeno Te+2 + H-1 H2Te Ácido telurhídrico Teluro de dihidrógeno
- 14. Sales neutras Las sales binarias son combinaciones de 2 elementos distintos del hidrógeno y del oxígeno. La unión de un elemento metálico con un elemento no metálico forman una sal neutra. Los tipos de sales neutras que existen son: fluoruros, cloruros, bromuros, yoduros, astaturos, sulfuros, telururos, seleniuros, nitruros, fosfuros, arseniuros, antimoniuros, boruros, carburos y siliciuros. La formulación de las sales neutras siguen el siguiente modelo: MaNb, donde M: elemento metálico, N: elemento no metálico, a: valencia del elemento no metálico y b: valencia del elemento metálico. Ejemplos: Valencias Compuesto Nomenclatura tradicional,… uro….seguido de hipo…oso,…oso, …ico, per…ico Nomenclatura sistemática prefijos (mono, di, tri, etc.) Nomenclatura stock números romanos (I, II, III, etc.) Una valencia Li+1 + F-1 LiF Fluoruro lítico Monofluoruro de litio Fluoruro de litio (I) Dos valencias Ni+2 + F-1 NiF2 Fluoruro niqueloso Difluoruro de niquel Fluoruro de niquel (II) Ni+3 + F-1 NiF3 Fluoruro niquélico Trifluoruro de niquel Fluoruro de niquel (III)
- 15. Hay que tener en cuenta que el elemento no metálico siempre actúa con la valencia fija y esta valencia será con la que actúa frente al hidrógeno. Por lo tanto los elementos no metálicos tendrán las siguientes valencias: F-1, Cl-1, Br-1, I-1, At-1, S-2, Te-2, Se-2, N-3, P-3, As-3, Sb-3, B-3, C-4, Si-4 Valencias Compuesto Nomenclatura tradicional,… uro….seguido de hipo…oso,…oso, …ico, per…ico Nomenclatura sistemática prefijos (mono, di, tri, etc.) Nomenclatura stock números romanos (I, II, III, etc.) Tres valencias Ti+2 + F-1 TiF2 Fluoruro hipotitanioso Difluoruro de titanio Fluoruro de titanio (II) Ti+3 + F-1 TiF3 Fluoruro titanioso Trifluoruro de titanio Fluoruro de titanio (III) Ti+4 + F-1 TiF4 Fluoruro titánico Tetrafluoruro de titanio Fluoruro de titanio (IV) Cuatro valencias U+3 + F-1 UF3 Fluoruro hipouranioso Trifluoruro de uranio Fluoruro de uranio (III) U+4 + F-1 UF4 Fluoruro uranioso Tetrafluoruro de uranio Fluoruro de uranio (IV) U+5 + F-1 UF5 Fluoruro uránico Pentafluoruro de uranio Fluoruro de uranio (V) U+6 + F-1 UF6 Fluoruro peruránico Hexafluoruro de uranio Fluoruro de uranio (VI)
- 16. Sales volátiles Las sales volátiles son combinaciones entre dos elementos no metales, siendo estos elementos distintos del oxígeno y el hidrógeno. Los tipos de sales volátiles que existen son los mismos que con las sales neutras: fluoruros, cloruros, bromuros, yoduros, astaturos, sulfuros, telururos, seleniuros, nitruros, fosfuros, arseniuros, antimoniuros, boruros, carburos y siliciuros. La formulación de las sales volátiles siguen el siguiente modelo: XaYb, donde X e Y son elementos no metálicos, a y b son las valencias de los respectivos elementos. Ejemplos: Valencias Compuesto Nomenclatura tradicional,… uro….seguido de hipo…oso,…oso, …ico, per…ico Nomenclatura sistemática prefijos (mono, di, tri, etc.) Nomenclatura stock números romanos (I, II, III, etc.) Una valencia B+1 + N-1 BN Nitruro bórico Mononitruro de boro Nitruro de boro (I) Dos valencias C+2 + S-2 CS Sulfuro carbonoso Monosulfuro de carbono Sulfuro de carbono (II) C+4 + S-2 CS2 Sulfuro carbónico Disulfuro de carbono Sulfuro de carbono (IV)
- 17. Además hay que tener en cuenta que el elemento Y siempre actúa con la valencia fija, y esta valencia será con la que actúa frente al hidrógeno. Por lo tanto el elemento Y tendrá las siguientes valencias: F-1, Cl-1, Br-1, I-1, At-1, S-2, Te-2, Se-2, N-3, P- 3, As-3, Sb-3, B-3, C-4, Si-4 Valencias Compuesto Nomenclatura tradicional,… uro….seguido de hipo…oso,…oso, …ico, per…ico Nomenclatura sistemática prefijos (mono, di, tri, etc.) Nomenclatura stock números romanos (I, II, III, etc.) Tres valencias N+1 + Br-1 NBr Bromuro hiponitroso Monobromuro de nitrógeno Bromuro de nitrógeno (I) N+3 + Br-1 NBr3 Bromuro nitroso Tribromuro de nitrógeno Bromuro de nitrógeno (III) N+5 + Br-1 NBr5 Bromuro nítrico Pentabromuro de nitrógeno Bromuro de nitrógeno (V) Cuatro valencias Br+1 + Cl-1 BrCl Cloruro hipobromoso Monocloruro de bromo Cloruro de bromo (I) Br+3 + Cl-1 BrCl3 Cloruro bromoso Tricloruro de bromo Cloruro de bromo (III) Br+5 + Cl-1 BrCl5 Cloruro brómico Pentacloruro de bromo Cloruro de bromo (V) Br+7 + Cl-1 BrCl7 Cloruro perbrómico heptacloruro de bromo Cloruro de bromo (VII)
- 18. Oxoácidos Los oxoácidos son combinaciones ternarias formadas por hidrógeno, un elemento no metal y el oxígeno (en ocasiones puede ser un elemento metálico del grupo del cromo, manganeso, wolframio o el vanadio ya que actúan como no metálicos en alto estado de oxidación). La fórmula general de los oxoácidos es HaXbOc donde el hidrógeno actúa con número de oxidación +1, el oxígeno actúa con número de oxidación -2 y el número de oxidación del elemento no metálico se calcula según la siguiente fórmula: X = (2c - a) / b Para la nomenclatura de los oxoácidos puede utilizarse la nomenclatura tradicional, nomenclatura de stock así como la nomenclatura sistemática. Anhídrido óxidoácido + H2O Ácido oxoácido Valencias Compuesto Nomenclatura tradicional, ácido seguido de hipo…oso,…oso, …ico, per…ico Nomenclatura sistemática prefijos (mono, di, tri, etc.)…seguido de ato y la valencia en números romanos. Nomenclatura stock números romanos (I, II, III, etc.) Una valencia B2O3 + H2O H3BO3 Ácido bórico Trioxoborato (III) de thidrógeno Ácido trioxobórico (III) Dos valencias SeO2 + H2O H2SeO3 Ácido selenoso Trioxoseleniato (IV) de hidrógeno Ácido trioxoselenico (IV) SeO3 + H2O H2ClO4 Ácido selenico Tetraoxoseleniato (VI) de hidrógeno Ácido tetraoxoselenico (VI)
- 19. Valencias Compuesto Nomenclatura tradicional, ácido seguido de hipo…oso,…oso, …ico, per…ico Nomenclatura sistemática prefijos (mono, di, tri, etc.)…seguido de ato y la valencia en números romanos. Nomenclatura stock números romanos (I, II, III, etc.) Tres valencias N2O2 + H2O HNO Ácido hiponitroso Monoxonitrato (II) de hidrógeno Ácido monoxonitrico (II) N2O3 + H2O HNO2 Ácido nitroso Dioxonitrato (III) de hidrógeno Ácido dioxonitrico (III) N2O5 + H2O HNO3 Ácido nítrico Trioxonitrato (V) de hidrógeno Ácido trioxonitrico (V) Cuatro valencias Cl2O + H2O HClO Ácido hipocloroso Monoxoclorato (I) de hidrógeno Ácido monoxoclórico (I) Cl2O3 + H2O HClO2 Ácido cloroso Dioxoclorato (III) de hidrógeno Ácido dioxoclórico (III) Cl2O5 + H2O HClO3 Ácido clórico Trioxoclorato (V) de hidrógeno Ácido trioxoclórico (V) Cl2O7 + H2O HClO4 Ácido perclórico Tetraoxoclorato (VII) de hidrógeno Ácido tetraoxoclórico (VII)
- 20. Oxisales La fórmula general de las oxisales es Ma(XbOc)n donde M es el elemento metálico, X es el elemento no metálico y O es el oxígeno. Los valores de a, b y c corresponden a los valores del oxoácido del que procede y n es la valencia del elemento metálico. Ácido oxoácido + Hidrógeno Sal oxisal + H2O Nomenclatura sistemática: Se nombra con el nombre del anión seguido por el nombre del catión y seguido por el prefijo que indica el numero de átomos del elemento metálico. En el caso de que el anión se encuentre entre paréntesis, el número de iones se indica mediante los prefijos griegos. Compuesto Nomenclatura tradicional terminación oso por ito e ico por ato Nomenclatura sistemática Prefijos griegos (dis, tris, tetrakis, ect.) Nomenclatura stock números romanos (I, II, III, etc.) H2CO3 + Ca(OH)2 Ca(CO3) + H2O Carbonato de calcio Trióxido carbonato de calcio Carbonato de calcio (II) H2SO4 + Fe(OH)3 Fe2(SO4)3 + H2O Sulfato férrico Tris (tetraóxido sulfato) de dihierro Sulfato de hierro (III) HClO2 + Na(OH) Na(ClO2) + H2O Clorito de sodio Dióxido clorito de sodio Clorito de sodio (I) Nomenclatura tradicional: se nombra de forma similar al ácido oxoácido del que procede sustituyendo la terminación -oso por -ito y la terminación -ico por -ato seguido del elemento metálico.