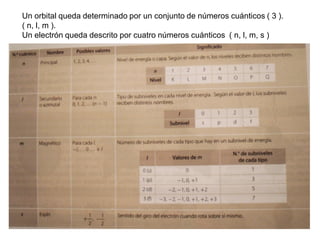
El documento describe la evolución de los modelos atómicos a lo largo de la historia, desde las primeras ideas de los filósofos griegos sobre la constitución de la materia hasta los modelos atómicos modernos. Explica que el modelo atómico de Dalton propuso que la materia estaba compuesta por átomos indivisibles, mientras que los descubrimientos posteriores llevaron al modelo de Thomson con un núcleo positivo y electrones. El modelo de Rutherford introdujo el concepto del núcleo atómico concentrado en el centro