Materia y energia
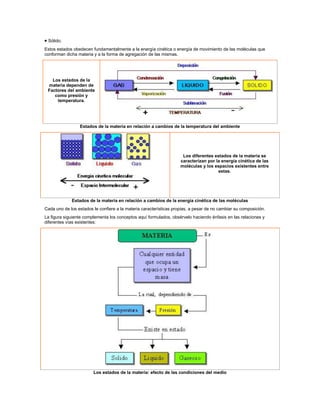
- 1. Sólido. Estos estados obedecen fundamentalmente a la energía cinética o energía de movimiento de las moléculas que conforman dicha materia y a la forma de agregación de las mismas. Los estados de la materia dependen de Factores del ambiente como presión y temperatura. Estados de la materia en relación a cambios de la temperatura del ambiente Los diferentes estados de la materia se caracterizan por la energía cinética de las moléculas y los espacios existentes entre estas. Estados de la materia en relación a cambios de la energía cinética de las moléculas Cada uno de los estados le confiere a la materia características propias, a pesar de no cambiar su composición. La figura siguiente complementa los conceptos aquí formulados, obsérvelo haciendo énfasis en las relaciones y diferentes vías existentes: Los estados de la materia: efecto de las condiciones del medio
- 2. Aunque la materia en sus diferentes estados, no varía en su composición, puede variar en sus características Principales Características de los estados de la materia SÓLIDOS LÍQUIDOS GASES No poseen forma definida, por lo No poseen forma definida, por lo Poseen forma definida. tanto adoptan la forma del tanto adoptan la forma del recipiente que los contiene. recipiente que los contiene. Poseen volumen fijo. Poseen volumen fijo. Poseen volumen variable. Baja compresibilidad. Compresión limitada. Alta Compresibilidad. Cambios físicos y cambios químicos Las modificaciones en la presión, la temperatura o las interrelaciones de las sustancias, pueden originar cambios físicos o químicos en la materia. Cambios físicos de la materia: Son aquellos cambios que no generan la creación de nuevas sustancias, lo que significa que no existen cambios en la composición de la materia, como se ve en la figura siguiente. El cambio físico se caracteriza por la no existencia de reacciones químicas y de cambios en la composición de la materia. Cambio físico de la materia: cambio de estado sólido (hielo) a estado líquido del agua, mediante el aumento en la temperatura del sistema. Cambios químicos: Son aquellos cambios en la materia que originan la formación de nuevas sustancias, lo que indica que existieron reacciones químicas. El cambio Químico de la materia se caracteriza por la existencia de reacciones químicas, de cambios en la composición de la materia y la formación de nuevas sustancias. Cambio Químico de la materia: Formación de Ácido Clorhídrico, mediante la reacción de Cloro e Hidrógeno.
- 3. Observe que en los cambios químicos la materia sometida al cambio posee unas características diferentes a la materia inicial. Composición y propiedades de la materia Como se vio anteriormente, la materia presenta tres estados físicos, dependiendo de factores ambientales como la presión y la temperatura; independiente de ello, el aspecto de la materia está determinado por las propiedades físico-químicas de sus componentes, encontrándose materia homogénea y materia heterogénea. Materia homogénea Energía El movimiento de los constituyentes de la materia, los cambios químicos y físicos y la formación de nuevas sustancias se originan gracias a cambios en la energía del sistema; conceptualmente, la energía es la capacidad para realizar un trabajo o transferir calor; la energía a su vez se presenta como energía calórica, energía mecánica, energía química, energía eléctrica y energía radiante; estos tipos de energía pueden ser además potencial o cinética. La energía potencial es la que posee una sustancia debido a su posición espacial o composición química y la energía cinética es la que posee una sustancia debido a su movimiento.
- 4. Tipos de energía Manifestaciones de la energía Energía Mecánica: El movimiento de las hélices del molino de viento es transferido a un sistema mecánico de piñones, para producir energía eléctrica o lograr la ascensión de agua de un pozo subterráneo
- 5. Cambio Químico de la materia: Formación de Ácido Clorhídrico, mediante la reacción de Cloro e Hidrógeno. Observe que en los cambios químicos la materia sometida al cambio posee unas características diferentes a la materia inicial. Composición y propiedades de la materia Como se vio anteriormente, la materia presenta tres estados físicos, dependiendo de factores ambientales como la presión y la temperatura; independiente de ello, el aspecto de la materia está determinado por las propiedades físico-químicas de sus componentes, encontrándose materia homogénea y materia heterogénea. Materia homogénea Es aquella que es uniforme en su composición y en sus propiedades y presenta una sola fase, ejemplo de ello sería un refresco gaseoso, la solución salina, el Cloruro de Sodio o sal de cocina; este tipo de materia se presenta en formas homogéneas, soluciones y sustancias puras. Materia heterogénea Es aquella que carece de uniformidad en su composición y en sus propiedades y presenta dos o más fases, ejemplo de ello sería la arena, el agua con aceite; este tipo de materia es también conocida como mezcla y se caracteriza por el mantenimiento de las propiedades de los componentes y la posibilidad que existe de separarlos por medio de métodos físicos. Sustancias puras, elementos y compuestos Sustancia pura Una sustancia es pura cuando se encuentra compuesta por uno o más elementos en proporciones definidas y constantes y cualquier parte de ella posee características similares, definidas y constantes; podríamos decir que una sustancia es pura cuando se encuentra compuesta en su totalidad por ella y no contiene cantidades de otras sustancias; ejemplos de ello serían la sacarosa, el agua, el oro. Elemento: Sustancia pura imposible de descomponer mediante métodos químicos ordinarios, en dos o más sustancias, ejemplo: el Hidrógeno (H), el Oxígeno (O), el Hierro (Fe), el Cobre (Cu). Compuesto: Sustancia pura posible de descomponer mediante métodos químicos ordinarios, en dos o más sustancias, ejemplos: El agua (H2O), la sal (NaCl), el ácido Sulfúrico (H2SO4).
- 6. Mapa conceptual que muestra la categorización de la materia, dependiendo de las características y composición de las sustancias constituyentes. Energía El movimiento de los constituyentes de la materia, los cambios químicos y físicos y la formación de nuevas sustancias se originan gracias a cambios en la energía del sistema; conceptualmente, la energía es la capacidad para realizar un trabajo o transferir calor; la energía a su vez se presenta como energía calórica, energía mecánica, energía química, energía eléctrica y energía radiante; estos tipos de energía pueden ser además potencial o cinética. La energía potencial es la que posee una sustancia debido a su posición espacial o composición química y la energía cinética es la que posee una sustancia debido a su movimiento
- 7. Calor especifico ¿Has sentido que unas sustancias se calientan con mayor rapidez que otras?, el calor especifico se relaciona con ello; conceptualmente, el calor específico es la cantidad de calor necesario para elevar la temperatura de una sustancia determinada; desde el punto de vista químico, es la cantidad de calorías requeridas para elevar en un grado centígrado la temperatura de un gramo de una sustancia, o es el número de joules requeridos para elevar en un grado kelvin la temperatura de un kg de una sustancia. Calor Específico del agua: 1 cal/g o C Este valor significa que para elevar 1 grado centígrado la temperatura de 1 g de agua, se requiere 1 caloría. Calor Especifico del Aluminio: 0,217 cal/g o C Este valor significa que para elevar 1 grado centígrado la temperatura de 1 g de Aluminio se requieren 0,217 calorías. Valores comparativos del calor especifico del agua en estado líquido y el aluminio en estado sólido. Ley de la conservación de Masa-Energía Para concluir esta parte temática, abordemos una pregunta: en el momento de ocurrir un cambio físico o químico (reacción química) en una sustancia, ¿existe perdida de masa y/o energía?