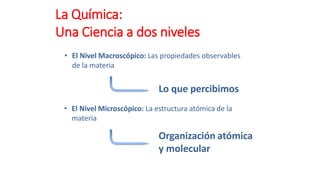
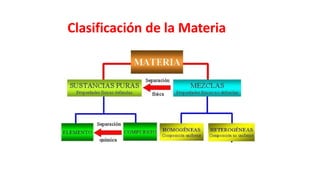
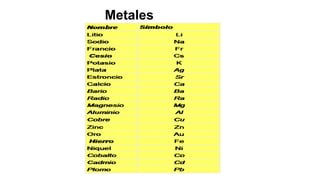
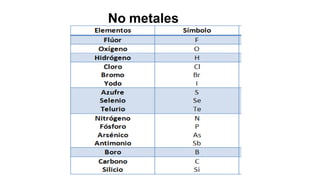
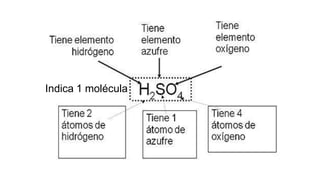
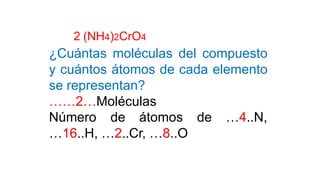
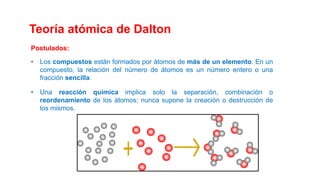
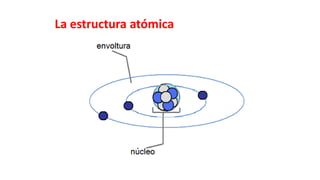
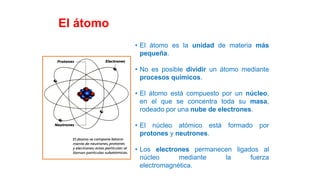
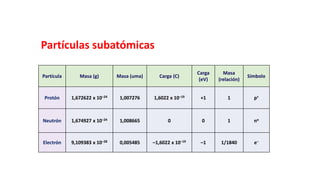
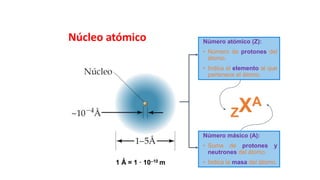
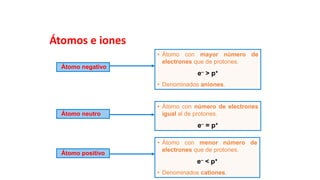
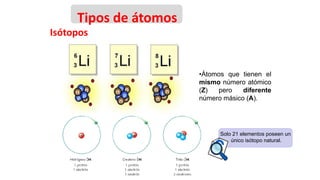
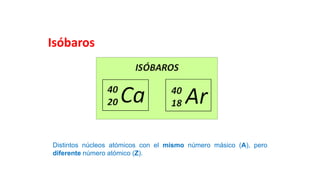
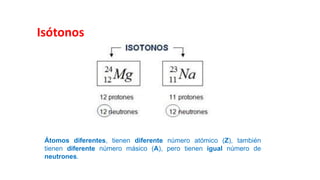
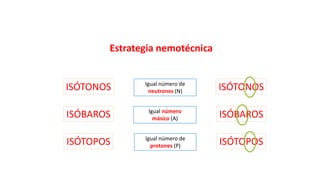
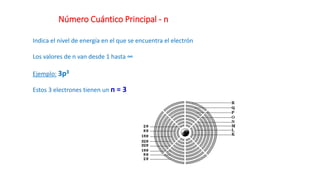
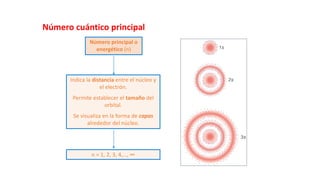
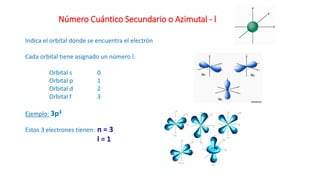
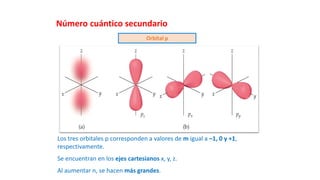
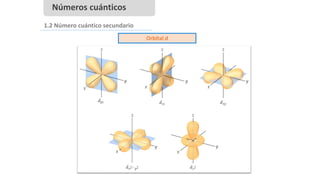
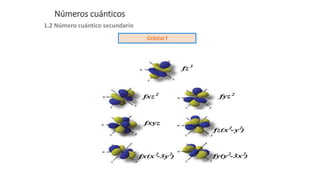
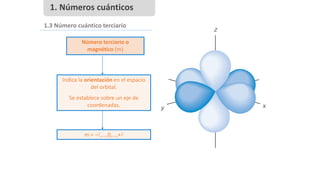
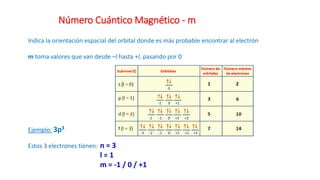
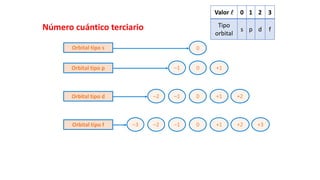
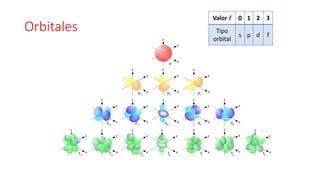
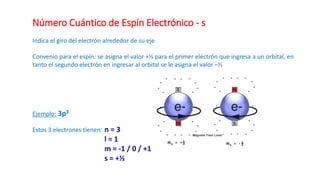
Este documento presenta conceptos generales sobre la química. Explica que la química estudia la materia a nivel macroscópico y microscópico. Define la química como la ciencia que estudia la estructura y propiedades de la materia, así como las transformaciones que experimenta durante las reacciones químicas. Describe los modelos atómicos de Thomson, Rutherford, Bohr y el modelo mecánico cuántico. Finalmente, explica la estructura del átomo, incluyendo las partículas subatómic