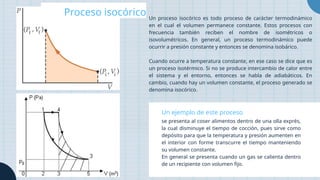
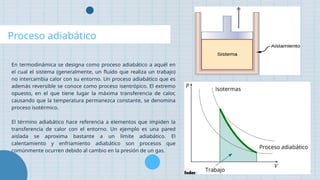
El documento describe los diferentes tipos de procesos termodinámicos, incluyendo los procesos isotérmico, isocórico, isobárico, adiabático y politrópico, destacando sus definiciones y ejemplos. Se explica cómo cada proceso se caracteriza por la permanencia de ciertas variables, como temperatura, presión o volumen, y las condiciones que los diferencian. Además, se proporcionan ejemplos prácticos para ilustrar cada tipo de proceso en situaciones cotidianas.