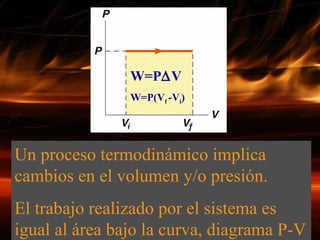
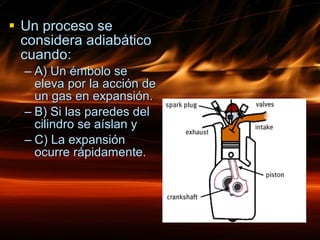
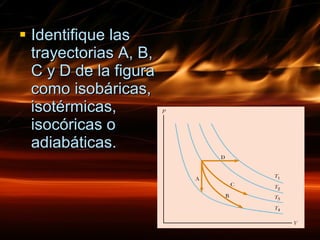
La primera ley de la termodinámica establece que la energía no se crea ni destruye, solo se transforma. El cambio en la energía interna de un sistema es igual al calor neto absorbido menos el trabajo realizado. Existen diferentes tipos de procesos termodinámicos como procesos isobáricos, isotérmicos, isocóricos y adiabáticos que implican cambios en la presión, volumen, temperatura y transferencia de calor.