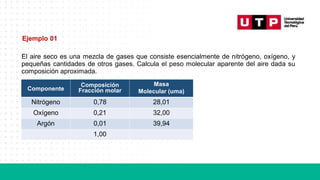
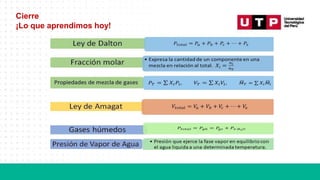
El documento aborda el tema de mezclas de gases en química, centrándose en las leyes de los gases ideales, como la ley de Dalton y la ley de Amagat, que permiten calcular presiones y volúmenes parciales de los gases. Se mencionan prácticas de cálculo de masa molecular promedio y aplicaciones en el contexto de la colección de gases sobre agua. Al final, se presentan ejercicios prácticos para aplicar lo aprendido sobre mezclas gaseosas.