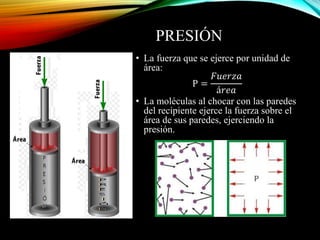
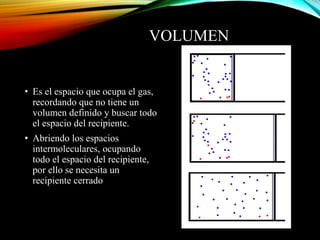
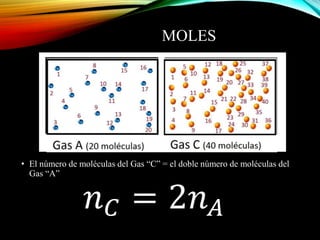
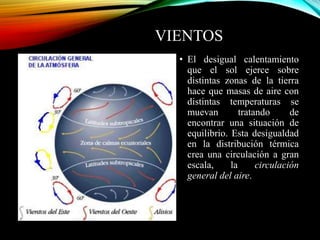
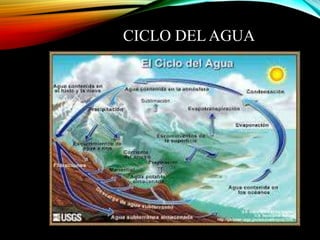
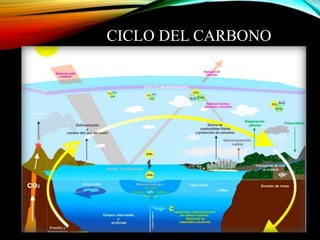
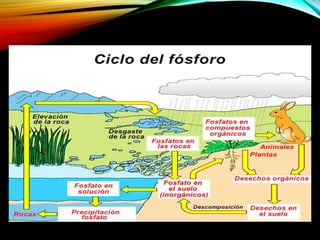
El documento resume los principales componentes de la atmósfera terrestre y algunos fenómenos físicos que ocurren en la troposfera. Explica que la troposfera contiene el 80% de la masa atmosférica y es donde ocurren los cambios climáticos. También describe la composición del aire, incluido el oxígeno, nitrógeno, vapor de agua y otros gases en proporciones pequeñas. Además, explica conceptos como presión, temperatura, vientos, humedad y precipitaciones que afectan