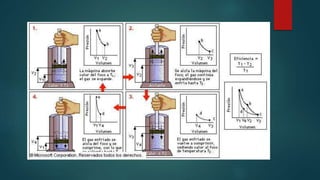
Este documento presenta información sobre termodinámica para un grupo de estudiantes de grado 11. Explica conceptos clave como temperatura, calor, energía interna y las leyes de la termodinámica. También describe procesos termodinámicos como cambios de estado de la materia a través de fusión, ebullición, solidificación y condensación.