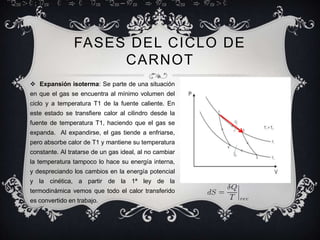
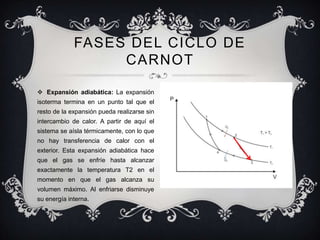
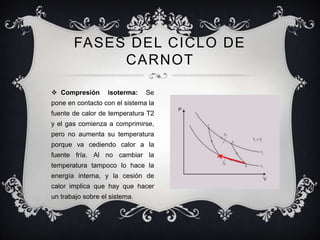
Este documento proporciona una introducción general a la termodinámica, incluyendo sus leyes fundamentales, conceptos clave como procesos iso, el ciclo de Carnot, y magnitudes termodinámicas como entropía y entalpía. Explica que la termodinámica estudia la transferencia de calor y su conversión en trabajo, y cómo surgió para comprender mejor las máquinas de vapor.