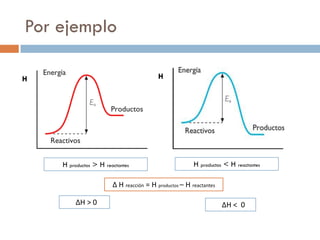
El documento resume conceptos clave de termodinámica como energía, trabajo, calor, primera ley de la termodinámica, reacciones químicas exotérmicas y endotérmicas, entalpía y cálculo de variación de entalpía utilizando energías de enlace. También presenta un ejemplo numérico para calcular la variación de entalpía de una reacción química y un ejercicio propuesto para practicar el cálculo.