Conceptos CAMILO RODRIGUEZ
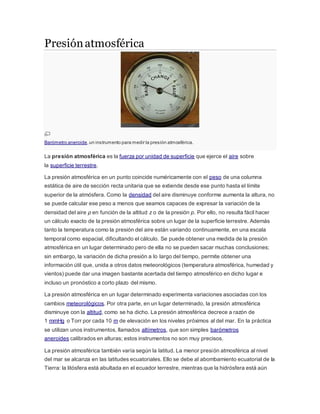
- 1. Presiónatmosférica Barómetro aneroide,un instrumento para medir la presión atmosférica. La presión atmosférica es la fuerza por unidad de superficie que ejerce el aire sobre la superficie terrestre. La presión atmosférica en un punto coincide numéricamente con el peso de una columna estática de aire de sección recta unitaria que se extiende desde ese punto hasta el límite superior de la atmósfera. Como la densidad del aire disminuye conforme aumenta la altura, no se puede calcular ese peso a menos que seamos capaces de expresar la variación de la densidad del aire ρ en función de la altitud z o de la presión p. Por ello, no resulta fácil hacer un cálculo exacto de la presión atmosférica sobre un lugar de la superficie terrestre. Además tanto la temperatura como la presión del aire están variando continuamente, en una escala temporal como espacial, dificultando el cálculo. Se puede obtener una medida de la presión atmosférica en un lugar determinado pero de ella no se pueden sacar muchas conclusiones; sin embargo, la variación de dicha presión a lo largo del tiempo, permite obtener una información útil que, unida a otros datos meteorológicos (temperatura atmosférica, humedad y vientos) puede dar una imagen bastante acertada del tiempo atmosférico en dicho lugar e incluso un pronóstico a corto plazo del mismo. La presión atmosférica en un lugar determinado experimenta variaciones asociadas con los cambios meteorológicos. Por otra parte, en un lugar determinado, la presión atmosférica disminuye con la altitud, como se ha dicho. La presión atmosférica decrece a razón de 1 mmHg o Torr por cada 10 m de elevación en los niveles próximos al del mar. En la práctica se utilizan unos instrumentos, llamados altímetros, que son simples barómetros aneroides calibrados en alturas; estos instrumentos no son muy precisos. La presión atmosférica también varía según la latitud. La menor presión atmosférica al nivel del mar se alcanza en las latitudes ecuatoriales. Ello se debe al abombamiento ecuatorial de la Tierra: la litósfera está abultada en el ecuador terrestre, mientras que la hidrósfera está aún
- 2. más abultada por lo que las costas de la zona ecuatorial se encuentran varios km más alejadas del centro de la Tierra que en las zonas templadas y, especialmente, en las zonas polares. Y, debido a su menor densidad, la atmósfera está mucho más abultada en el ecuador terrestre que la hidrósfera, por lo que su espesor es mucho mayor que el que tiene en las zonas templadas y polares. Por ello, la zona ecuatorial es el dominio permanente de bajas presiones atmosféricas por razones dinámicas derivadas de la rotación terrestre. También por ello, la temperatura atmosférica disminuye un grado por cada 154 m de altitud, mientras que en la zona intertropical esta cifra alcanza unos 180 m de altitud. La presión atmosférica normalizada, 1 atmósfera, fue definida como la presión atmosférica media al nivel del mar que se adoptó como exactamente 101 325 Pa o 760 Torr. Sin embargo, a partir de 1982, la IUPAC recomendó que si se trata de especificar las propiedades físicas de las sustancias la "presión normalizada" debía definirse como exactamente 100 kPa o (≈750,062 Torr). Aparte de ser un número redondo, este cambio tiene una ventaja práctica porque 100 kPa equivalen a unaaltitud aproximada de 112 metros, que está cercana al promedio de 194 m de la población mundial.1 Índice [ocultar] 1 Historia 2 Presión atmosférica y altura 3 Estabilidad e inestabilidad atmosférica 4 Véase también 5 Referencias 6 Bibliografía 7 Enlaces externos Historia[editar]
- 3. Elexperimento de Torricelli con un tubo y mercurio. En la antigüedad estaban lejos de sospechar el peso del aire. Lo consideraban como un cuerpo que por su naturaleza tendía a elevarse; explicándose la ascensión de los líquidos en las bombas por el horror vacui, «horror al vacío», que tiene la naturaleza. Cuando unos jardineros de italianos quisieron elevar agua aspirando con una bomba de hélice, apreciaron que no podían superar la altura de 10,33 m (cerca de 34 pies). Consultado Galileo, determinó éste que el horror de la naturaleza al vacío se limitaba con una fuerza equivalente al peso de 10,33 m de agua (lo que viene a ser 1 atm de presión), y denominó a dicha altura altezza limitatíssima. En 1643, Torricelli tomó un tubo de vidrio de un metro de longitud y lo llenó de «plata viva» (mercurio). Manteniendo el tubo cerrado con el dedo, lo invirtió e introdujo en una vasija con mercurio. Al retirar el dedo comprobó que el metal descendía hasta formar una columna cuya altura era 13,6 veces menor que la que se obtenía al realizar el experimento con agua. Como sabía que el mercurio era 13,6 veces más pesado que el agua, dedujo que ambas columnas de líquido soportaban el mismo contrapeso, sospechando que solo el aire era capaz de realizar dichafuerza. Luego de la temprana muerte de Torricelli, llegaron sus experimentos a oídos de Pascal, a través del Padre Mersenne que los dio a conocer por medio de un tratado, actualmente depositado en París.[cita requerida] Aunque aceptando inicialmente la teoría del horror al vacío, no tardó Pascal en cambiar de idea al observar los resultados de los experimentos que realizó.
- 4. Empleando un tubo curvado y usándolo de forma que la atmósfera no tuviera ninguna influencia sobre el líquido, observó que las columnas llegaban al mismo nivel. Sin embargo, cuando permitía la acción de la atmósfera en uno de los ramales, el nivel variaba. Barómetro de mercurio,como el empleado por Pascal para medir la presión atmosférica Estos resultados le indujeron a abordar el experimento definitivo, consistente en transportar el barómetro a distintas altitudes y comprobar si era realmente el peso del aire el que determinaba la ascensión del líquido en el tubo. Al escribir a Perier, uno de sus parientes, el 15 de noviembre de 1647 acerca del experimento proyectado, decía: Si sucede que la altura de la plata viva es menor en lo alto de la montaña que abajo, se deducirá necesariamente que la gravedad y presión del aire son la única causa de esta suspensión de la plata viva, y no el horror al vacío, porque es verdad que hay mucho más aire que pese al pie de la montaña que en su vértice. El 19 de septiembre de 1648, Pelier cumplió el deseo de su cuñado y realizó el experimento ascendiendo a la cima del Puy-de-Dôme. Comparando la medida realizada en la cima, situada a una altura de 500 toesas (cerca de 1000 m), con la de base, tomada por el padre Chastin, hallaron una diferencia de tres líneas y media entre ambas. La idea del horror vacui quedó definitivamente abandonada: el aire pesaba. Sin dudar del mérito de la realización del experimento, sin embargo Descartes fue quien, en carta escrita en 1638, 12 años antes del experimento de Torricelli, afirmaba ya que:
- 5. El aire es pesado, se lo puede comparar a un vasto manto de lana que envuelve la Tierra hasta más allá de las nubes; el peso de esta lana comprime la superficie del mercurio en la cuba, impidiendo que descienda la columna mercurial. No obstante, el concepto de presión atmosférica no empezó a extenderse hasta la demostración, en 1654, del burgomaestre e inventor Otto von Guericke quien, con sus hemisferios de Magdeburgo, cautivó al público y a personajes ilustres de la época. Presión atmosférica y altura[editar] Artículo principal: Pisos térmicos La altura modifica tanto la temperatura como la presión atmosféricas al modificarse la densidad del aire. El fenómeno es muy sencillo: el aire se calienta en contacto con la superficie terrestre, tanto en la parte sólida como en la superficie de los océanos y mares, especialmente, en este último caso. Al calentarse el aire se eleva porque disminuye de densidad y por lo tanto, de presión y asciende hasta equilibrarse la temperatura de la columna ascendente del aire con su entorno a un nivel superior. Sin embargo, la comprensión de este proceso es mucho más compleja, ya que las variaciones de la presión no varían exclusivamente con la altura sino con otros factores como son la mayor o menor humedad y con la latitud, que modifica sustancialmente el mayor o menor espesor de la atmósfera por razones dinámicas: este espesor es máximo en la zona ecuatorial debido a la fuerza centrífuga de la rotación terrestre en dicha zona y, por ende, menor en los polos. Estabilidad e inestabilidad atmosférica[editar] Cuando el aire está frío, desciende, haciendo aumentar la presión y provocando estabilidad. Se forma, entonces, un anticiclón. Cuando el aire está caliente, asciende, haciendo bajar la presión y provocando inestabilidad. Se forma así un ciclón o borrasca. Además, el aire frío y el cálido no se mezclan de manera inmediata, debido a la diferencia de densidades; y cuando se encuentran en superficie, el aire frío empuja hacia arriba al aire caliente provocando un descenso de la presión e inestabilidad, por causas dinámicas. Se forma entonces un ciclón, o borrasca dinámica. Esta zona de contacto es la que se conoce como frente. Véase también[editar] Presión Para otros usos de este término, véase Presión (desambiguación).
- 6. Distribución de presiones sobre un cilindro que se mueve a velocidad constante en el seno de un fluido ideal. Esquema;se representa cada "elemento"con una fuerza dP y un área dS. Animación:efecto de la presión en el volumen de un gas.
- 7. La presión (símbolo p)1 2 es una magnitud física que mide la proyección de la fuerza en dirección perpendicular porunidad de superficie, y sirve para caracterizar cómo se aplica una determinada fuerza resultante sobre una línea. En elSistema Internacional de Unidades la presión se mide en una unidad derivada que se denomina pascal (Pa) que es equivalente a una fuerza total de un newton actuando uniformemente en un metro cuadrado. En el Sistema Inglés la presión se mide en libra por pulgada cuadrada (pound per square inch o psi) que es equivalente a una fuerza total de una libra actuando en una pulgada cuadrada. Índice [ocultar] 1 Definición o 1.1 Presión absoluta y relativa o 1.2 Presión hidrostática e hidrodinámica o 1.3 Presión de un gas 1.3.1 Propiedades de la presión en un medio fluido 2 Aplicaciones o 2.1 Frenos hidráulicos o 2.2 Refrigeración o 2.3 Neumáticos de los automóviles 3 Presión ejercida por los líquidos 4 Unidades de medida, presión y sus factores de conversión 5 Véase también 6 Referencias 7 Enlaces externos Definición[editar] La presión es la magnitud escalar que relaciona la fuerza con la superficie sobre la cual actúa, es decir,equivale a la fuerza que actúa sobre la superficie. Cuando sobre una superficie plana de área A se aplica una fuerza normal F de manera uniforme, la presión P viene dada de la siguiente forma: En un caso general donde la fuerza puede tener cualquier dirección y no estar distribuida uniformemente en cada punto la presión se define como:
- 8. Donde es un vector unitario y normal a la superficie en el punto donde se pretende medir la presión. La definición anterior puede escribirse también como: donde: , es la fuerza por unidad de superficie. , es el vector normal a la superficie. , es el área total de la superficie S. Presión absoluta y relativa[editar] En determinadas aplicaciones la presión se mide no como la presión absoluta sino como la presión por encima de la presión atmosférica, denominándose presión relativa, presión normal, presión de gauge o presión manométrica. Consecuentemente, la presión absoluta es la presión atmosférica (Pa) más la presión manométrica (Pm) (presión que se mide con el manómetro). Presión hidrostática e hidrodinámica[editar] Artículo principal: Presión en un fluido En un fluido en movimiento la presión hidrostática puede diferir de la llamada presión hidrodinámica por lo que debe especificarse a cual de las dos se está refiriendo una cierta medida de presión. Presión de un gas[editar] En el marco de la teoría cinética la presión de un gas es explicada como el resultado macroscópico de las fuerzas implicadas por las colisiones de las moléculas del gas con las paredes del contenedor. La presión puede definirse por lo tanto haciendo referencia a las propiedades microscópicas del gas: Para un gas ideal con N moléculas, cada una de masa m y moviéndose con una velocidad aleatoria promedio vrms contenido en un volumen cúbico V las partículas del gas impactan con las paredes del recipiente de una manera que puede calcularse de manera estadística intercambiando momento lineal con las paredes
- 9. en cada choque y efectuando una fuerza neta por unidad de área que es la presión ejercida por el gas sobre la superficie sólida. La presión puede calcularse entonces como (gas ideal) Este resultado es interesante y significativo no sólo por ofrecer una forma de calcular la presión de un gas sino porque relaciona una variable macroscópica observable, la presión, con la energía cinética promedio por molécula, 1/2 mvrms², que es una magnitud microscópica no observable directamente. Nótese que el producto de la presión por el volumen del recipiente es dos tercios de la energía cinética total de las moléculas de gas contenidas. Propiedades de la presión en un medio fluido[editar] Manómetro. 1. La fuerza asociada a la presión en un fluido ordinario en reposo se dirige siempre hacia el exterior del fluido, por lo que debido al principio de acción y reacción, resulta en una compresión para el fluido, jamás una tracción. 2. La superficie libre de un líquido en reposo (y situado en un campo gravitatorio constante) es siempre horizontal. Eso es cierto sólo en la superficie de la Tierra y a simple vista, debido a la acción de la gravedad constante. Si no hay acciones gravitatorias, la superficie de un fluido es esférica y, por tanto, no horizontal. 3. En los fluidos en reposo, un punto cualquiera de una masa líquida está sometida a una presión que es función únicamente de la profundidad a la que se encuentra el punto. Otro punto a la misma profundidad, tendrá la misma presión. A la superficie imaginaria que
- 10. pasa por ambos puntos se llama superficie equipotencial de presión o superficie isobárica. Aplicaciones[editar] Frenos hidráulicos[editar] Muchos automóviles tienen sistemas de frenado antibloqueo (ABS, siglas en inglés) para impedir que la fuerza de fricción de los frenos bloqueen las ruedas, provocando que el automóvil derrape. En un sistema de frenado antibloqueo un sensor controla la rotación de las ruedas del coche cuando los frenos entran en funcionamiento. Si una rueda está a punto de bloquearse los sensores detectan que la velocidad de rotación está bajando de forma brusca, y disminuyen la presión del freno un instante para impedir que se bloquee. Comparándolo con los sistemas de frenado tradicionales, los sistemas de frenado antibloqueo consiguen que el conductor controle con más eficacia el automóvil en estas situaciones, sobre todo si la carretera está mojada o cubierta por la nieve. Refrigeración[editar] La refrigeración se basa en la aplicación alternativa de presión elevada y baja, haciendo circular un fluido en los momentos de presión por una tubería. Cuando el fluido pasa de presión elevada a baja en el evaporador, el fluido se enfría y retira el calor de dentro del refrigerador. Como el fluido se encuentra en un ciclo cerrado, al ser comprimido por un compresor para elevar su temperatura en el condensador, que también cambia de estado a líquido a alta presión, nuevamente está listo para volverse a expandir y a retirar calor (recordemos que el frío no existe es solo una ausencia de calor). Neumáticos de los automóviles[editar] Se inflan a una presión de 310.263,75 Pa, lo que equivale a 30 psi (utilizando el psi como unidad de presión relativa a la presión atmosférica). Esto se hace para que los neumáticos tengan elasticidad ante fuertes golpes (muy frecuentes al ir en el automóvil). El aire queda encerrado a mayor presión que la atmosférica dentro de las cámaras (casi 3 veces mayor), y en los neumáticos más modernos entre la cubierta de caucho flexible y la llanta que es de un metal rígido. Presión ejercida por los líquidos[editar]
- 11. La presión que se origina en la superficie libre de los líquidos contenidos en tubos capilares, o en gotas líquidas se denomina presión capilar. Se produce debido a la tensión superficial. En una gota es inversamente proporcional a su radio, llegando a alcanzar valores considerables. Por ejemplo, en una gota de mercurio de una diezmilésima de milímetro de diámetro hay una presión capilar de 100 atmósferas. La presión hidrostática corresponde al cociente entre la fuerza normal F que actúa, en el seno de un fluido, sobre una cara de un cuerpo y que es independiente de la orientación de ésta. Depende únicamente de la profundidad a la que se encuentra situado el elemento considerado. La de un vapor, que se encuentra en equilibrio dinámico con un sólido o líquido a una temperatura cualquiera y que depende únicamente de dicha temperatura y no del volumen, se designa con el nombre de presión de vapor o saturación. Véanse también: Presión hidrostática y Prensa hidráulica. Unidades de medida, presión y sus factores de conversión[editar] La presión atmosférica media es de 101 325 pascales (101,3 kPa), a nivel del mar, donde 1 Atm = 1,01325 bar = 101325 Pa = 1,033 kgf/cm² y 1 m.c.a = 9,81 kPa. La presión atmosférica media es de 101 325 pascales (101,3 kPa), a nivel del mar, donde 1 Atm = 1,01325 bar = 101325 Pa = 1,033 kgf/cm²y 1 m.c.a= 9,81 kPa.Unidades de presióny sus factores de conversión Unidades de presión y sus factores de conversión Pascal bar N/mm² kp/m² kp/cm² atm Torr PSI 1 Pa (N/m² )= 1 10-5 10-6 0,102 0,102× 10-4 0,987× 10-5 0,007 5 0,00014 503 1 bar (10N 105 1 0,1 10200 1,02 0,987 750 14.5036
- 12. /cm²) = 1 N/mm² = 106 10 1 1,02× 105 10,2 9,87 7500 145.053 6 1 kp/m² = 9,81 9,81×1 0-5 9,81×1 0-6 1 10-4 0,968× 10-4 0,073 6 0.00142 2 1 kp/cm² = 9,81x10 4 0,981 0,0981 10000 1 0,968 736 14.2209 4 1 atm (760 Torr) = 101325 1,0132 5 0,1013 10330 1,033 1 760 14.6948 0 Pascal bar N/mm² kp/m² kp/cm² atm Torr PSI 1 Pa (N/m² )= 1 10-5 10-6 0,102 0,102× 10-4 0,987× 10-5 0,007 5 0,00014 503 1 bar (10N /cm²) = 105 1 0,1 10200 1,02 0,987 750 14.5036 1 N/mm² = 106 10 1 1,02× 105 10,2 9,87 7500 145.053 6 1 kp/m² = 9,81 9,81×1 0-5 9,81×1 0-6 1 10-4 0,968× 10-4 0,073 6 0.00142 2 1 kp/cm² = 9,81x10 0,981 0,0981 10000 1 0,968 736 14.2209
- 13. 4 4 1 atm (760 Torr) = 101325 1,0132 5 0,1013 10330 1,033 1 760 14.6948 0 1 Torr (m mHg) = 133,32 0,0013 332 1,3332 ×10-4 13,6 1,36x1 0-3 1,32x1 0-3 1 0.01933 6 1 PSI (libra / pulgada cuadrada) = 6894.75 729 0.6894 8 0.0689 4 703.1 88 0.0703 188 0.6804 6 51.71 49 1 Las obsoletas unidades manométricas de presión, como los milímetros de mercurio, están basadas en la presión ejercida por el peso de algún tipo estándar de fluido bajo cierta gravedad estándar. Las unidades de presión manométricas no deben ser utilizadas para propósitos científicos o técnicos, debido a la falta de repetibilidad inherente a sus definiciones. También se utilizan los milímetros de columna de agua (mm c.d.a.). 1 Torr (mm Hg) = 133,32 0,00133 32 1,3332× 10-4 13,6 1,36x10 -3 1,32x 10-3 1 0.0193 36 1 PSI (libra / pulgada cuadrada) = 6894.75 729 0.68948 0.06894 703.1 88 0.07031 88 0.680 46 51.71 49 1 Las obsoletas unidades manométricas de presión, como los milímetros de mercurio, están basadas en la presión ejercida por el peso de algún tipo estándar de fluido bajo cierta gravedad estándar. Las unidades de presión manométricas no deben ser utilizadas para propósitos científicos o técnicos, debido a la falta de repetibilidad inherente a sus definiciones. También se utilizan los milímetros de columna de agua (mm c.d.a.).
- 14. Véase también[editar] Presión atmosférica (barometría) La presión atmosférica es la fuerza que el peso de la columna de atmósfera por encima del punto de medición ejerce por unidad de área. La unidad de medición en el sistema métrico decimal es el hectoPascal (hPa) que corresponde a una fuerza de 100 Newton sobre un metro cuadrado de superficie. La variación de la presión con la altura es mucho mayor que la variación horizontal, de modo que para hacer comparables mediciones en lugares distintos, hay que referirlas a un nivel común (usualmente el nivel del mar). BAROMETRO DE MERCURIO (Hg) Lo que se mide es la altura de una columna de mercurio cuyo peso es compensado por la presión de la atmósfera. El modelo más frecuente (barómetro Fortin) está constituido por un tubo de vidrio cuyo extremo superior está sellado. El tubo se llena de mercurio, y luego se invierte, con el extremo inferior colocado en un recipiente con mercurio. La diferencia entre los niveles del mercurio en el interior del tubo y en el recipiente inferior corresponde a la presión atmosférica y normalmente se expresa en milímetros. A continuación se indica su correspondencia con otras unidades de presión. 1 mm de mercurio (a 0°C) = 1.332 hPa 1 hPa = 1 milibar (mb) 1 atmósfera estándar = 1013.25 hPa Radiosonda antigua BAROMETRO ANEROIDE Está constituido por una cámara en cuyo interior se ha hecho el vacío. Una de las paredes de la cámara actúa como un diafragma que se deforma en respuesta a los cambios de presión exterior Es frecuente que se coloquen varias cámaras en series para amplificar la señal. En la figura adjunta, se observa un sensor de presión de este tipo en una radiosonda antigua.
- 15. HIPSOMETRO Este instrumento se basa en el hecho que la temperatura de ebullición de un cierto líquido depende de la presión atmosférica. El aparato de medición incluye una pequeña cámara que contiene un fluido y un calefactor que lo mantiene en ebullición. La cámara se extiende hacia arriba en forma de una columna en cuyas paredes se produce la condensación, lo cual permite recuperar el fluido hacia la cámara inferior. Mediante un sensor especial se mide la temperatura de ebullición. Esta técnica de medición de presión se utiliza en algunos sistemasde radiosondeos (por ejemplo en el Servicio Meteorológico de Suiza) Propiedades de los gases El estado gaseoso es un estado disperso de la materia,es decir , que las moléculas del gas están separadas unas de otras por distancias mucho mayores del tamaño del diámetro real de las moléculas.Resuelta entonces,que el volumen ocupado por el gas(V) depende de la presión (P),la temperatura (T) y de la cantidad o numero de moles ( n). Las propiedades de la materia en estado gaseoso son: 1. Se adaptan a la forma y el volumen del recipiente que los contiene.Un gas,al cambiar de recipiente,se expande o se comprime,de manera que ocupa todo el volumen y toma la forma de su nuevo recipiente. 2. Se dejan comprimir fácilmente.Al existir espacios intermoleculares,las moléculas se pueden acercar unas a otras reduciendo su volumen,cuando aplicamos una presión. 3. Se difunden fácilmente.Al no existir fuerza de atracción intermolecular entre sus partículas, los gases se esparcen en forma espontánea. 4. Se dilatan,la energía cinética promedio de sus moléculas es directamente proporcional a la temperatura aplicada. Variables que afectan el comportamiento de los gases 1. PRESIÓN Es la fuerza ejercida por unidad de área. En los gases esta fuerza actúa en forma uniforme sobre todas las partes del recipiente. La presión atmosférica es la fuerza ejercida por la atmósfera sobre los cuerpos que están en la superficie terrestre.Se origina del peso del aire que la forma. Mientras más alto se halle un cuerpo menos aire hay por encima de él, por consiguiente la presión sobre él será menor. 2. TEMPERATURA Recipentes de gas.
- 16. Es una medida de la intensidad del calor,y el calor a su vez es una forma de energía que podemos medir en unidades de calorías.Cuando un cuerpo caliente se coloca en contacto con uno frío, el calor fluye del cuerpo caliente al cuerpo frío. La temperatura de un gas es proporcional a la energía cinética media de las moléculas del gas.A mayor energía cinética mayor temperatura y viceversa. La temperatura de los gases se expresa en grados kelvin. 3. CANTIDAD La cantidad de un gas se puede medir en unidades de masa,usualmente en gramos.De acuerdo con el sistema de unidades SI,la cantidad también se expresa mediante el número de moles de sustancia,esta puede calcularse dividiendo el peso del gas por su peso molecular. 4. VOLUMEN Es el espacio ocupado por un cuerpo. 5. DENSIDAD Es la relación que se establece entre el peso molecular en gramos de un gas y su volumen molar en litros. Gas Real Los gases reales son los que en condiciones ordinarias de temperatura ypresión se comportan como gases ideales;pero si latemperatura es muybaja o la presión muyalta, las propiedades de los gases reales se desvían en forma considerable de las de gases ideales. Concepto de Gas Ideal y diferencia entre Gas Ideal y Real. Los Gases que se ajusten a estas suposiciones se llaman gases ideales y aquellas que no se les llama gases reales,o sea,hidrógeno,oxígeno, nitrógeno y otros. 1. - Un gas esta formado por partículas llamadas moléculas. Dependiendo del gas,cada molécula esta formada por un átomo o un grupo de átomos.Si el gas es un elemento o un compuesto en su estado estable, consideramos que todas sus moléculas son idénticas. 2. - Las moléculas se encuentran animadas de movimiento aleatorio y obedecen las leyes de Newton del movimiento. Las moléculas se mueven en todas direcciones y a velocidades diferentes.Al calcular las propiedades del movimiento suponemos que la mecánica newtoniana se puede aplicar en el nivel microscópico.Como para todas nuestras suposiciones,esta mantendrá o desechara,dependiendo de sílos hechos experimentales indican o no que nuestras predicciones son correctas. 3. - El numero total de moléculas es grande. La dirección y la rapidez del movimiento de cualquiera de las moléculas puede cambiar bruscamente en los choques con las paredes o con otras moléculas.Cualquiera de las moléculas en particular,seguirá una trayectoria de zigzag, debido a dichos choques.Sin embargo,como hay muchas moléculas,suponemos que el gran numero de choques resultante mantiene una distribución total de las velocidades moleculares con un movimiento promedio aleatorio. 4. - El volumen de las moléculas es una fracción despreciablemente pequeña del volumen ocupado por el gas. Aunque hay muchas moléculas,son extremadamente pequeñas.Sabemos que el volumen ocupado por una gas se puede cambiar en un margen muyamplio,con poca dificultad y que,cuando un gas se condensa,el volumen ocupado por el gas comprimido hasta dejarlo en forma líquida puede ser miles de veces menor.Por ejemplo,un gas natural puede licuarse yreducir en 600 veces su volumen. Volumen de un gas.
- 17. 5. - No actúan fuerzas apreciables sobre las moléculas, excepto durante los choques. En el grado de que esto sea cierto, una molécula se moverá con velocidad uniformemente los choques.Como hemos supuesto que las moléculas sean tan pequeñas,la distancia media entre ellas es grande en comparación con el tamaño de una de las moléculas.De aquíque supongamos que el alcance de las fuerzas moleculares es comparable al tamaño molecular. 6. - Los choques son elásticos y de duración despreciable. En los choques entre las moléculas con las paredes del recipiente se conserva el ímpetu y (suponemos)la energía cinética.Debido a que el tiempo de choque es despreciable comparado con el tiempo que transcurre entre el choque de moléculas,la energía cinética que se convierte en energía potencial durante el choque,queda disponible de nuevo como energía cinética,después de un tiempo tan corto, que podemos ignorar este cambio por completo. Ver: Leyes de los gases Ver: Modelo corpuscular de gases Leyes de los gases A modo de recordatorio.¿Cuáles son los estados de la materia?:sólido, líquido y gaseoso, que dependen de la presión y de latemperatura a la que se encuentran sometidos. En el estado sólido la fuerza de cohesión de las moléculas hace que estas estén muypróximas unas de otros con escaso margen de movimiento entre ellas. En el estado líquido esta fuerza de cohesión molecular es menor lo cual permite mayor libertad de movimiento entre ellas. En el estado gaseoso la fuerza de cohesión de las moléculas es muypequeña,prácticamente nula, lo cual permite que estas se muevan libremente y en todas direcciones. En este capítulo nos dedicaremos a estudiar este comportamiento de los gases para encontrar una explicación al mismo. Antes de entrar de lleno en el estudio de las leyes que explican el comportamiento de los gases, veamos cómo influyen en este los eventos físicos que los alteran y que son: temperatura,presión y volumen, además de la cantidad de que se trate. Temperatura La temperatura (T) ejerce gran influencia sobre el estado de las moléculas de un gas aumentando o disminuyendo la velocidad de las mismas.Para trabajar con nuestras fórmulas siempre expresaremos la temperatura en grados Kelvin. Cuando la escala usada esté en grados Celsius,debemos hacer la conversión,sabiendo que 0ºC equivale a + 273,15 º Kelvin. Distintas materias, distintas fuerzas de cohesión molecular.
- 18. Presión En Física, presión (P) se define como la relación que existe entre unafuerza (F) y la superficie (S) sobre la que se aplica,y se calcula con la fórmula Lo cual significa que la Presión (P) es igual a la Fuerza (F) aplicada dividido por la superficie (S) sobre la cual se aplica. En nuestras fórmulas usaremos como unidad de presión la atmósfera (atm) y el milímetro de mercurio (mmHg), sabiendo que una atmósfera equivale a 760 mmHg. Volumen Recordemos que volumen es todo el espacio ocupado por algún tipo de materia.En el caso de los gases, estos ocupan todo el volumen disponible del recipiente que los contiene. Hay muchas unidades para medir el volumen,pero en nuestras fórmulas us aremos el litro (L) y el milílitro (ml). Recordemos que un litro equivale a mil milílitros: 1 L = 1.000 mL También sabemos que 1 L equivale a 1 decímetro cúbico (1 dm 3 ) o a mil centímetros cúbicos (1.000 cm3 ) ,lo cual hace equivalentes (iguales) 1 mL con 1 cm3: 1 L = 1 dm3 = 1.000 cm3 = 1.000 mL 1 cm3 = 1 mL 1 atm es igual a 760 mmHg de presión.
- 19. Cantidad de gas Otro parámetro que debe considerarse al estudiar el comportamiento de los gases tiene que ver con la cantidad de un gas la cual se relaciona con el número total de moléculas que la componen. Para medir la cantidad de un gas usamos como unidad de medida elmol. Como recordatorio diremos que un mol (ya sea de moléculas o de átomos) es igual a 6,022 por 10 elevado a 23: 1 mol de moléculas = 6,022•1023 1 mol de átomos = 6,022•1023 Ver: PSU: Química; Pregunta 13_2006 Recuerden que este número corresponde al llamado númerode Avogadro y este nos conduce a una ley llamada,precisamente, leyde Avogadro. Ley de Avogadro Esta ley relaciona la cantidad de gas (n, en moles) con su volumen en litros (L), considerando que la presión y la temperatura permanecen constantes (no varían). El enunciado de la ley dice que: El volumen de un gas es directamente proporcional a la cantidad del mismo. Esto significa que: Si aumentamos la cantidad de gas,aumentará el volumen del mismo. Si disminuimos la cantidad de gas,disminuirá el volumen del mismo. Esto tan simple,podemos expresarlo en términos matemáticos con la siguiente fórmula: que se traduce en que si dividimos el volumen de un gas por el número de moles que lo conforman obtendremos un valor constante. Un mol de moléculas o de átomos: 6,022•1023
- 20. Esto debido a que si ponemos más moles (cantidad de moléculas) de un gas en un recipiente tendremos, obviamente,más gas (más volumen),asíde simple. Esto se expresa en la ecuación , simplificada es Veamos un ejemplo práctico y sencillo: Tenemos 3,50 L de un gas que, sabemos,corresponde a 0,875 mol.Inyectamos gas al recipiente hasta llegar a 1,40 mol,¿cuál será el nuevo volumen del gas? (la temperatura y la presión las mantenemos constantes). Solución: Aplicamos la ecuación de la ley de Avogadro: y reemplazamos los valores correspondientes: resolvemos la ecuación,multiplicando en forma cruzada: Ahora, despejamos V2, para ello, pasamos completo a la izquierda el miembro con la incógnita (V2), y hacemos: Respuesta: El nuevo volumen (V2), ya que aumentamos los moles hasta 1,40 (n2), es ahora 5,6 L Tan simple como: más gas, mayor volumen.
- 21. Ley de Boyle Esta ley nos permite relacionar la presión y el volumen de un gas cuando latemperatura es constante. La ley de Boyle (conocida también como de Boyle y Mariotte) establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente,cuando la temperatura es constante. Lo cual significa que: El volumen de un gas es inversamente proporcional a la presión que se le aplica: En otras palabras: Si la presión aumenta,el volumen disminuye. Si la presión disminuye,el volumen aumenta. Esto nos conduce a que,si la cantidad de gas y la temperatura permanecen constantes,el producto de la presión por el volumen siempre tiene el mismo valor. Matemáticamente esto es: lo cual significa que el producto de la presión por el volumen es constante. Para aclarar el concepto: Tenemos un cierto volumen de gas (V1) que se encuentra a una presión P1. Si variamos la presión a P2, el volumen de gas variará hasta un nuevo valor V2, y se cumplirá: que es otra manera de expresar la ley de Boyle. Apliquemos la fórmula en un ejemplo práctico: Tenemos 4 L de un gas que están a 600 mmHg de presión.¿Cuál será su volumen si aumentamos la presión hasta 800 mmHg? La temperatura es constante,no varía. Solución: Como los datos de presión están ambos en milímetros de mercurio (mmHg) no es necesario hacer la conversión a atmósferas (atm).Si solo uno de ellos estuviera en mmHg y el otro en atm, habría que dejar los dos en atm. Aclarado esto,sustituimos los valores en la ecuación P1V1 = P2V2. Ponemos a la izquierda el miembro con la incógnita Presión y volumen: si una sube, el otro baja.
- 22. Despejamos V2: Respuesta: Si aumentamos la presión hasta 800 mmHg el volumen disminuye hasta llegar a los 3 L. Ley de Charles Mediante esta ley relacionamos la temperatura y el volumen de un gas cuando mantenemos la presión constante. Textualmente,la ley afirma que: El volumen de un gas es directamente proporcional a la temperatura del gas. En otras palabras: Si aumenta la temperatura aplicada al gas,el volumen del gas aumenta. Si disminuye la temperatura aplicada al gas,el volumen del gas disminuye. Como lo descubrió Charles,si la cantidad de gas y la presión permanecen constantes,el cociente entre el volumen (V) y la temperatura (T) siempre tiene el mismo valor (K) (es constante). Matemáticamente esto se expresa en la fórmula lo cual significa que el cociente entre el volumen y la temperatura es constante. Intentemos ejemplificar: Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una temperatura T1. Si aumentamos la temperatura a T2 el volumen del gas aumentará hasta V2, y se cumplirá que: que es otra manera de expresar la ley de Charles. Veamos un ejemplo práctico y sencillo: A mayor temperatura, mayor volumen.
- 23. Un gas cuya temperatura llega a 25° C tiene un volumen de 2,5 L. Para experimentar,bajamos la temperatura a 10° C ¿Cuál será su nuevo volumen? Solución: El primer paso es recordar que en todas estas fórmulas referidas a la temperatura hayque usar siempre la escala Kelvin. Por lo tanto, lo primero es expresar la temperatura en grados Kelvin: T1 = (25 + 273) K= 298 K T2 = (10 + 273 ) K= 283 K Ahora, sustituimos los datos en la ecuación: Ahora, despejamos V2: Respuesta: Si bajamos la temperatura hasta los 10ºC (283º K) el nuevo volumen del gas será 2,37 L.
- 24. Ley de Gay-Lussac Esta ley establece la relación entre la presión (P) y la temperatura (T) de un gas cuando el volumen (V) se mantiene constante,y dice textualmente: La presión del gas es directamente proporcional a su temperatura. Esto significa que: Si aumentamos la temperatura,aumentará la presión. Si disminuimos la temperatura,disminuirá la presión. Si lo llevamos al plano matemático,esto queda demostrado con la siguiente ecuación: la cual nos indica que el cociente entre la presión y la temperatura siempre tiene el mismo valor;es decir, es constante. Llevemos esto a la práctica y supongamos que tenemos un gas,cuyo volumen (V) no varía, a una presión P1 y a una temperatura T1. Para experimentar,variamos la temperatura hasta un nuevo valor T2, entonces la presión cambiará a P2, y tendrá que cumplirse la siguiente ecuación: que es la misma Leyde Gay-Lussac expresada de otra forma. Debemos recordar,además,que esta ley, al igual que la de Charles,está expresada en función de la temperatura absoluta,y tal como en la Ley de Charles,las temperaturas han de expresarse en grados Kelvin. Veamos un ejemplo: Tenemos un cierto volumen de un gas bajo una presión de 970 mmHg cuando su temperatura es de 25° C. ¿A qué temperatura deberá estar para que su presión sea 760 mmHg? Solución: Lo primero que debemos hacer es convertir los 25ºC a grados Kelvin: T1 = (25 + 273) K= 298 K Ahora sustituimos los datos en la ecuación: Ahora despejamos T2: A mayor temperatura, mayor presión.
- 25. Respuesta: La temperatura debe bajar hasta los 233,5ºKelvin.Si convertimos estos grados en grados Celsius h acemos 233,5 − 273 = −39,5 °C. Ley general de los gases o ecuación general de los gases Las leyes parciales analizada precedentemente pueden combinarse yobtener una ley o ecuación que relaciones todas las variables al mismo tiempo. Según esta ecuación o ley general Esto significa que,si tenemos una cantidad fija de gas y sobre la misma variamos las condiciones de presión (P), volumen (V) o temperatura (T) el resultado de aplicar esta fórmula con diferentes valores,será una constante. Veamos un ejemplo,para aclarar: Supongamos que tenemos una cierta cantidad fija de un gas (n1), que está a una presión (P1), ocupando un volumen (V1) a una temperatura (T1). Estas variables se relacionan entre sícumpliendo con la siguiente ecuación: Donde R es una constante universal conocida ya que se puede determinar en forma experimental. La misma fómula nos permite calcular el volumen molar de un gas (n): (Ver: PSU: Química; Pregunta 11_2006) A modo de experimento,a la misma cantidad fija de gas (n1) le cambiamos el valor a alguna de las variables tendremos entonces una nueva presión (P2),un nuevo volumen (V2) y una nueva temperatura (T2). Como ya conocemos le ecuación general colocamos en ella los valores de cada variable: Según la condición inicial: Según la condición final:
- 26. Vemos que en ambas condiciones la cantidad de gas (n1) es la misma y que la constante R tampoco varía. Entonces,despejamos n1R en ambas ecuaciones: Marcamos con rojo n1R para señalar que ambos resultados deben ser iguales entre sí,por lo tanto: Algo para recordar y utilizar: Cuando se dice que dos elementos o cantidades son inversamente proporcionales,deben multiplicarse entre sí cada vez que sus valores varían y el resultado tiene que ser siempre el mismo (constante). Ahora, cuando dos elementos o cantidades son directamente proporcionales,deben dividirse entre sícada vez que sus valores varían y el resultado tiene que ser siempre el mismo (constante). Para otros usos de este término, véase Gas (desambiguación). La temperatura de un gas ideal monoatómico es una medida relacionada con la energía cinéticapromedio de sus moléculas al moverse.En esta animación,la relación del tamaño de los átomos dehelio respecto a su separación se conseguiría bajo una presión de 1950 atmósferas.Estos átomos a temperatura ambiente tienen una cierta velocidad media (aquíreducida dos billones de veces).
- 27. Se denomina gas al estado de agregación de la materia en el cual, bajo ciertas condiciones de temperatura y presión, sus moléculas intereaccionan solo débilmente entre sí, sin formar enlaces moleculares, adoptando la forma y el volumen del recipiente que las contiene y tendiendo a separarse, esto es, expandirse, todo lo posible por su alta energía cinética. Los gases son fluidos altamente compresibles, que experimentan grandes cambios de densidad con la presión y la temperatura. Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras, explicando así las propiedades: Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a que se mueven sus moléculas. Los gases ocupan completamente el volumen del recipiente que los contiene. Los gases no tienen forma definida, adoptando la de los recipientes que las contiene. Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras. A temperatura y presión ambientales los gases pueden ser elementos como el hidrógeno, el oxígeno, el nitrógeno, el cloro, el flúor y los gases nobles, compuestos como el dióxido de carbono o el propano, o mezclas como el aire. Los vapores y el plasma comparten propiedades con los gases y pueden formar mezclas homogéneas, por ejemplo vapor de agua y aire, en conjunto son conocidos como cuerpos gaseosos, estado gaseoso o fase gaseosa. Índice [ocultar] 1 Historia 2 Leyes de los gases o 2.1 Ley de Boyle-Mariotte o 2.2 Ley de Charles o 2.3 Ley de Gay-Lussac o 2.4 Ley general de los gases o 2.5 Ley de los gases ideales 3 Gases reales 4 Comportamiento de los gases
- 28. o 4.1 Cambios de densidad o 4.2 Presión de un gas 5 Véase también 6 Enlaces externos Historia[editar] En 1648, el químico Jan Baptist van Helmont, considerado el padre de la química neumática, creó el vocablo gas (durante un tiempo se usó también "estado aeriforme"), a partir del término griego kaos (desorden) para definir las características del anhídrido carbónico. Esta denominación se extendió luego a todos loscuerpos gaseosos, también llamados fluidos elásticos, fluidos compresibles o aires, y se utiliza para designar uno de los estados de la materia. La principal característica de los gases respecto de los sólidos y los líquidos, es que no pueden verse ni tocarse, pero también se encuentran compuestos de átomos y moléculas. La causa de la naturaleza del gas se encuentra en sus moléculas, muy separadas unas de otras y con movimientos aleatorios entre sí. Al igual que ocurre con los otros dos estados de la materia, el gas también puede transformarse (en líquido) si se somete a temperaturas muy bajas. A este proceso se le denominacondensación en el caso de los vapores y licuefacción en el caso de los gases perfectos. La mayoría de los gases necesitan temperaturas muy bajas para lograr condensarse. Por ejemplo, en el caso del oxígeno, la temperatura necesaria es de -183 °C. Las primeras leyes de los gases fueron desarrollados desde finales del siglo XVII, cuando los científicos empezaron a darse cuenta de que en las relaciones entre la presión, el volumen y la temperatura de una muestra de gas, en un sistema cerrado, se podría obtener una fórmula que sería válida para todos los gases. Éstos se comportan de forma similar en una amplia variedad de condiciones, debido a la buena aproximación que tienen las moléculas que se encuentran más separadas, y hoy en día la ecuación de estado para un gas ideal se deriva de la teoría cinética. Ahora las leyes anteriores de los gases se consideran como casos especiales de la ecuación del gas ideal, con una o más de las variables mantenidas constantes. Empíricamente, se observan una serie de relaciones proporcionales entre la temperatura, la presión y el volumen que dan lugar a la ley de los gases ideales, deducida por primera vez por Émile Clapeyron en 1834. Leyes de los gases[editar]
- 29. Existen diversas leyes derivadas de modelos simplificados de la realidad que relacionan la presión, el volumen y la temperatura de un gas. Ley de Boyle-Mariotte[editar] Artículo principal: Ley de Boyle-Mariotte La Ley de Boyle-Mariotte (o Ley de Boyle), formulada por Robert Boyle y Edme Mariotte, es una de las leyes de los gases que relaciona el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante. La ley dice que a una temperatura constante y para una masa dada de un gas el volumen del gas varia de manera inversamente proporcional a la presión absoluta del recipiente: Ley de Charles[editar] Artículo principal: Ley de Charles A una presión dada, el volumen ocupado por una cierta cantidad de un gas es directamente proporcional a su temperatura. Matemáticamente la expresión sería: o . en términos generales: (V1 * T2) = (V2 * T1) Ley de Gay-Lussac[editar] Artículo principal: Ley de Gay-Lussac La presión de una cierta cantidad de gas, que se mantiene a volumen constante, es directamente proporcional a la temperatura: Es por esto que para poder envasar gas, como gas licuado, primero ha de enfriarse el volumen de gas deseado, hasta una temperatura característica de cada gas, a fin de poder someterlo a la presión requerida para licuarlo sin que se sobrecaliente y eventualmente, explote. Ley generalde los gases[editar] Artículo principal: Ley general de los gases
- 30. Combinando las tres leyes anteriores se obtiene: Ley de los gases ideales[editar] Artículo principal: Ley de los gases ideales De la ley general de los gases se obtiene la ley de los gases ideales. Su expresión matemática es: siendo P la presión, V el volumen, n el número de moles, R la constante universal de los gases ideales y T la temperatura en Kelvin. Tomando el volumen de un mol a una atmósfera de presión y a 273 K, como 22,4 l se obtiene el valor de R= 0,082 atm·l·K−1·mol−1 El valor de R depende de las unidades que se estén utilizando: R = 0,082 atm·l·K−1·mol−1 si se trabaja con atmósferas y litros R = 8,31451 J·K−1·mol−1 si se trabaja en Sistema Internacional de Unidades R = 1,987 cal·K−1·mol−1 R = 8,31451 10−10 erg ·K−1·mol−1 R = 8,317x10−3 (m³)(Kpa)/(mol)(K) si se trabaja con metros cúbicos y kilo pascales De esta ley se deduce que un mol (6,022 x 10^23 átomos o moléculas) de gas ideal ocupa siempre un volumen igual a 22,4 litros a 0 °C y 1 atmósfera. Véase también Volumen molar. También se le llama la ecuación de estado de los gases, ya que solo depende del estado actual en que se encuentre el gas. Gases reales[editar] Artículo principal: Gas real Si se quiere afinar más, o si se quiere medir el comportamiento de algún gas que escapa al comportamiento ideal, habrá que recurrir a las ecuaciones de los gases reales, que son variadas y más complicadas cuanto más precisas. Los gases reales no se expanden infinitamente, sino que llegaría un momento en el que no ocuparían más volumen. Esto se debe a que entre sus partículas, ya sean átomos como en los gases nobles o moléculas como en el
- 31. (O2) y la mayoría de los gases, se establecen unas fuerzas bastante pequeñas, debido a los cambios aleatorios de sus cargas electrostáticas, a las que se llama fuerzas de Van der Waals. El comportamiento de un gas suele concordar más con el comportamiento ideal cuanto más sencilla sea su fórmula química y cuanto menor sea su reactividad ( tendencia a formar enlaces). Así, por ejemplo, los gases nobles al ser moléculas monoatómicas y tener muy baja reactividad, sobre todo el helio, tendrán un comportamiento bastante cercano al ideal. Les seguirán los gases diatómicos, en particular el más liviano hidrógeno. Menos ideales serán los triatómicos, como eldióxido de carbono; el caso del vapor de agua aún es peor, ya que la molécula al ser polar tiende a establecer puentes de hidrógeno, lo que aún reduce más la idealidad. Dentro de los gases orgánicos, el que tendrá un comportamiento más ideal será el metano, perdiendo idealidad a medida que se engrosa la cadena de carbono. Así, el butano es de esperar que tenga un comportamiento ya bastante alejado de la idealidad. Esto es, porque cuanto más grande es la partícula constituyente del gas, mayor es la probabilidad de colisión e interacción entre ellas, factor que hace disminuir la idealidad. Algunos de estos gases se pueden aproximar bastante bien mediante las ecuaciones ideales, mientras que en otros casos hará falta recurrir a ecuaciones reales muchas veces deducidas empíricamente a partir del ajuste de parámetros. También se pierde la idealidad en condiciones extremas, como altas presiones o bajas temperaturas. Por otra parte, la concordancia con la idealidad puede aumentar si trabajamos a bajas presiones o altas temperaturas. También por su estabilidad química. Comportamiento de los gases[editar] Para el comportamiento térmico de partículas de la materia existen cuatro cantidades medibles que son de gran interés: presión, volumen, temperatura y masa de la muestra del material (o mejor aún cantidad de sustancia, medida en moles). Cualquier gas se considera como un fluido, porque tiene las propiedades que le permiten comportarse como tal. Sus moléculas, en continuo movimiento, colisionan elásticamente entre sí y contra las paredes del recipiente que contiene al gas, contra las que ejercen una presión permanente. Si el gas se calienta, esta energía calorífica se
- 32. invierte en energía cinética de las moléculas, es decir, las moléculas se mueven con mayor velocidad, por lo que el número de choques contra las paredes del recipiente aumenta en número y energía. Como consecuencia la presión del gas aumenta, y si las paredes del recipiente no son rígidas, el volumen del gas aumenta. Un gas tiende a ser activo químicamente debido a que su superficie molecular es también grande, es decir, al estar sus partículas en continuo movimiento chocando unas con otras, esto hace más fácil el contacto entre una sustancia y otra, aumentando la velocidad de reacción en comparación con los líquidos o los sólidos. Para entender mejor el comportamiento de un gas, siempre se realizan estudios con respecto al gas ideal, aunque éste en realidad nunca existe y las propiedades de éste son: Una sustancia gaseosa pura está constituida por moléculas de igual tamaño y masa. Una mezcla de sustancias gaseosas está formada por moléculas diferentes en tamaño y masa. Debido a la gran distancia entre unas moléculas y otras y a que se mueven a gran velocidad, las fuerzas de atracción entre las moléculas se consideran despreciables. El tamaño de las moléculas del gas es muy pequeño, por lo que el volumen que ocupan las moléculas es despreciable en comparación con el volumen total del recipiente. La densidad de un gas es muy baja. Las moléculas de un gas se encuentran en constante movimiento a gran velocidad, por lo que chocan elásticamente de forma continua entre sí y contra las paredes del recipiente que las contiene. Para explicar el comportamiento de los gases, las nuevas teorías utilizan tanto la estadística como la teoría cuántica, además de experimentar con gases de diferentes propiedades o propiedades límite, como el UF6, que es el gas más pesado conocido. Un gas no tiene forma ni volumen fijo; se caracteriza por la casi nula cohesión y la gran energía cinética de sus moléculas, las cuales se mueven. Cambios de densidad[editar] El efecto de la temperatura y la presión en los sólidos y líquidos es muy pequeño, por lo que típicamente la compresibilidad de un líquido o sólido es
- 33. de 10−6 bar−1(1 bar=0,1 MPa) y el coeficiente de dilatación térmica es de 10−5 K−1. Por otro lado, la densidad de los gases es fuertemente afectada por la presión y la temperatura. La ley de los gases ideales describe matemáticamente la relación entre estas tres magnitudes: donde es la constante universal de los gases ideales, es la presión del gas, su masa molar y la temperatura absoluta. Eso significa que un gas ideal a 300 K (27 °C) y 1 atm duplicará su densidad si se aumenta la presión a 2 atm manteniendo la temperatura constante o, alternativamente, se reduce su temperatura a 150 K manteniendo la presión constante. Presión de un gas[editar] En el marco de la teoría cinética, la presión de un gas es explicada como el resultado macroscópico de las fuerzas implicadas por las colisiones de las moléculas del gas con las paredes del contenedor. La presión puede definirse por lo tanto haciendo referencia a las propiedades microscópicas del gas. En efecto, para un gas ideal con N moléculas, cada una de masa m y moviéndose con una velocidad aleatoria promedio vrms contenido en un volumen cúbico V, las partículas del gas impactan con las paredes del recipiente de una manera que puede calcularse de manera estadística intercambiando momento lineal con las paredes en cada choque y efectuando una fuerza neta por unidad de área, que es la presión ejercida por el gas sobre la superficie sólida. La presión puede calcularse como: (gas ideal) Este resultado es interesante y significativo no solo por ofrecer una forma de calcular la presión de un gas sino porque relaciona una variable macroscópica observable, la presión, con la energía cinética promedio por molécula, 1/2 mvrms², que es una magnitud microscópica no observable directamente. Nótese que el producto de la presión por el volumen del recipiente es dos tercios de la energía cinética total de las moléculas de gas contenidas.
- 34. Procesoisotérmico Proceso isotérmico. Se denomina proceso isotérmico o proceso isotermo al cambio reversible en un sistema termodinámico, siendo dicho cambio a temperatura constante en todo el sistema. La compresión o expansión de un gas ideal puede llevarse a cabo colocando el gas en contacto térmico con otro sistema de Capacidad calorífica muy grande y a la misma temperatura que el gas; este otro sistema se conoce como foco calórico. De esta manera, el calor se transfiere muy lentamente, permitiendo que el gas se expanda realizando trabajo. Como la energía interna de un gas ideal sólo depende de la temperatura y ésta permanece constante en la expansión isoterma, el calor tomado del foco es igual al trabajo realizado por el gas: Q = W. Una curva isoterma es una línea que sobre un diagrama representa los valores sucesivos de las diversas variables de un sistema en un proceso isotermo. Las isotermas de un gas ideal en un diagrama P-V, llamado diagrama de Clapeyron, son hipérbolas equiláteras, cuya ecuación es P•V = constante. Proceso isotérmico de un gas[editar] Una expansión isotérmica es un proceso en el cual un gas se expande (o contrae), manteniendo la temperatura constante durante dicho proceso, es decir que T1 = T2 para los estados inicial (1) y final (2) del proceso isotérmico. Aplicando el primer principio de la termodinámica se obtiene: Entonces integrando la expresión anterior, tomando como estado inicial el estado 1 y estado final el estado 2, se obtiene: ..........(1)
- 35. Por la definición de trabajo dada en mecánica se tiene que: Pero la fuerza se puede expresar en función de la presión que se ejerce el gas, y el desplazamiento se puede escribir como dx, entonces: Pero Adx equivale a dV, el aumento en el volumen del gas durante esta pequeña expansión, entonces el trabajo efectuado por el gas sobre los alrededores como resultado de la expansión es: ..........(2) Ahora reemplazando (1) en (2) se puede integrar: ..........(3) Pero para integrar la tercera integral, es necesario conocer la forma de variación de la presión P con el volumen, durante el proceso tratado. En el caso de tratar con gases ideales, se tendría la relación: ..........(4) Por lo tanto reemplazando (4) en (3) se tiene que: Como los valores n y R son constantes para cada gas ideal, y en este caso la temperatura también es constante, éstas pueden salir fuera de la integral obteniéndose: Ahora integrando: ..........(5) Pero se sabe que la energía interna depende sólo de la temperatura (Ver: La energía interna como función de la temperatura), y como en este proceso ésta se mantiene constante, no hay cambio en la energía
- 36. interna del gas, por lo que la expresión (5) se reduce a: Por lo tanto, en una expansión isotérmica de un gas perfecto, el calor de entrada es igual al trabajo efectua Aire Para otros usos de este término, véase Aire (desambiguación). Se denomina aire a la mezcla de gases que constituye la atmósfera terrestre, que permanecen alrededor del planeta Tierra por acción de la fuerza de gravedad. El aire es esencial para la vida en el planeta y transparente en distancias cortas y medias. En proporciones ligeramente variables, está compuesto por nitrógeno (78 %), oxígeno (21 %), vapor de agua (0-7 %), y otras sustancias (1 %), como ozono, dióxido de carbono, hidrógeno y gases nobles (como kriptón y argón). Índice [ocultar] 1 Propiedades del aire 2 Propiedades físicas 3 Composición del aire 4 Referencias 5 Enlaces externos Propiedades del aire[editar] Artículo principal: Atmósfera terrestre
- 37. Composición de la atmósfera terrestre (tomada en diciembre de 1987).El gráfico de la parte inferior indica los gases menos comunes que componen el 0,038 % de la atmósfera.Los valores están redondeados para la ilustración. Según la altitud, la temperatura y la composición del aire, la atmósfera terrestre se divide en cuatro capas: troposfera,estratosfera, mesosfera y termosfera. A mayor altitud disminuyen la presión y el peso del aire. Las porciones más importantes para el análisis de la contaminación atmosférica son las dos capas cercanas a la Tierra: la troposfera y la estratosfera. El aire de la troposfera interviene en la respiración. Por volumen está compuesto, aproximadamente, por 78,08 % de nitrógeno (N2), 20,94 % de oxígeno (O2), 0,035 % de dióxido de carbono (CO2) y 0,93 % de gases inertes, como argón y neón. En esta capa, de 7 km de altura en los polos y 16 km en los trópicos, se encuentran las nubes y casi todo el vapor de agua. En ella se generan todos los fenómenos atmosféricos que originan el clima. Más arriba, aproximadamente a 25 kilómetros de altura, en la estratosfera, se encuentra la capa de ozono, que protege a la Tierra de los rayos ultravioleta (UV). En relación con esto vale la pena recordar que, en términos generales, un contaminante es una substancia que está «fuera de lugar», y que un buen ejemplo de ello puede ser el caso del ozono (O3).
- 38. Cuando este gas se encuentra en el aire que se respira, es decir bajo los 25 kilómetros de altura habituales, es contaminante y constituye un poderoso antiséptico que ejerce un efecto dañino para la salud, por lo cual en esas circunstancias se le conoce como ozono troposférico u ozono malo. Sin embargo, el mismo gas, cuando está en la estratosfera, forma la capa que protege de los rayos ultravioleta del Sol a todos los seres vivientes (vida) de la Tierra, por lo cual se le identifica como ozono bueno. Véanse también: Capa de ozono y Ozono. Propiedades físicas[editar] Temperatur a [°C] Densidad[kg/m3 ] Viscosida d absoluta [Pa s] Viscosida d cinemátic a [m2 /s] Constant e particula r [J/kg K] Calor específico a presión constante [J/kg K] Calor específic o a volumen constant e [J/kg K] Coeficient e de dilatación adiabática 0 1,29 1,71 × 10-5 1,33 × 10-5 287 1000 716 1,40 50 1,09 1,95 × 10-5 1,79 × 10-5 287 - - - 100 0,946 2,17 × 10-5 2,30 × 10-5 287 1010 723 1,40 150 0,835 2,38 × 10-5 2.85 × 10-5 287 - - - 200 0,746 2,57 × 10-5 3,45 × 10-5 287 1020 737 1,39 250 0,675 2,75 × 10-5 4,08 × 10-5 287 - - - 300 0,616 2,93 × 10-5 4,75 × 10-5 287 1040 758 1,38 400 0,525 3,25 × 10-5 6,20 × 10-5 287 1070 781 1,37 500 0,457 3,55 × 10-5 7,77 × 10-5 287 1090 805 1,36
- 39. Nota: Valores a 1 atm (1.01325×105 Pa). Referencia: www.efunda.com1 Composición del aire[editar] El aire está compuesto principalmente por nitrógeno, oxígeno y argón. El resto de los componentes, entre los cuales se encuentran los gases de efecto invernadero, son vapor de agua, dióxido de carbono, metano, óxido nitroso, ozono, entre otros.2 En pequeñas cantidades pueden existir sustancias de otro tipo:polvo, polen, esporas y ceniza volcánica. También son detectables gases vertidos a la atmósfera en calidad de contaminantes, como cloro y sus compuestos, flúor,mercurio y compuestos de azufre. Composición de la atmósfera libre de vapor de agua, por volumen3 Porcentaje por volumen Gas Volumen (%) Nitrógeno (N2) 78,084 Oxígeno (O2) 20,946 Argón (Ar) 0,9340 Dióxido de carbono (CO2) 0,035 Neón (Ne) 0,001818 Helio (He) 0,000524 Metano (CH4) 0,000179 Kriptón (Kr) 0,000114 Hidrógeno (H2) 0,000055
- 40. Óxido nitroso (N2O) 0,00003 Monóxido de carbono (CO) 0,00001 Xenón (Xe) 0,000009 Ozono (O3) 0 a 7×10−6 Dióxido de nitrógeno (NO2) 0,000002 Yodo (I2) 0,000001 Amoníaco (NH3) Trazas No incluido en aire seco: Vapor de agua (H2O) ~0,40 % en capas altas de la atmósfera; normalmente 1 a 4 % en la superficie. Propiedades físicas y químicas del Aire Propiedades físicas Es de menor peso que el agua. Es de menor densidad que el agua. Tiene Volumen indefinido. No existe en el vacío. Es incoloro,inodoro e insípido. Propiedades químicas Reacciona con la temperatura condensándose en hielo a bajas temperaturas yproduce corrientes de aire. Esta compuesto por varios elementos entre ellos el oxigeno (O2) y el dioxido de carbono elementos básicos para la vida. Composición del Aire puro De acuerdo con la altitud,composición, temperatura yotras características,la atmósfera que rodea a la Tierra y comprende las siguientes capas o regiones:
- 41. 1. Troposfera. Alcanza una altura media de 12 km.(es de 7km.En los polos y de 16km.En los trópicos) y en ella encontramos,junto con el aire,polvo, humo y vapor de agua, entre otros componentes. 1. Estratosfera. Zona bastante mente fría que se extiende de los 12 a los 50km de altura; en su capa superior (entre los 20 y los 50km) contiene gran cantidad de ozono (O3), el cual es de enorme importancia para la vida en la tierra por que absorbe la mayor parte de los rayos ultravioleta del sol. 1. Mesosfera. Zona que se sitúa entre los 50 y los 100km de altitud; su temperatura media es de 10 °C;en ella los meteoritos adquieren altas temperaturas yen su gran mayoría se volatilizan y consumen.. 1. Ionosfera. Empieza después de los 100km.Y va desapareciendo gradualmente hasta los 500km de altura. En esta región,constituida por oxígeno (02), la temperatura aumenta hasta los 1000°C;los rayos X y ultravioleta del Sol ionizan el aire enrarecido,produciendo átomos ymoléculas cargados eléctricamente (que reciben el nombre de iones) yelectrones libres. 1. Exosfera. Comienza a 500km.de altura y extiende más allá de los 1000km;está formada por una capa de helio y otra de hidrogeno.Después de esa capa se halla una enorme banda de radiaciones (conocida como magnetosfera) que se extiende hasta unos 55000km de altura , aunque no constituye propiamente un estrato atmosférico. El aire limpio y puro forma una capa de aproximadamente 500 000 millones de toneladas que rodea la Tierra, de las su composición es la siguiente: Componente Concentración aproximada 1. Nitrógeno (N) 78.03% en volumen Oxígeno (O) 20.99% en volumen Dióxido de Carbono (CO2) 0.03% en volumen Argón (Ar) 0.94% en volumen Neón (Ne) 0.00123% en volumen Helio (He) 0.0004% en volumen Criptón (Kr) 0.00005% en volumen Xenón (Xe) 0.000006% en volumen Hidrógeno (H) 0.01% en volumen Metano (CH4) 0.0002% en volumen Óxido nitroso (N2O) 0.00005% en volumen
- 42. Vapor de Agua (H2O) Variable Ozono (O3) Variable Partículas Variable Contaminación atmosférica La contaminación del aire es uno de los problemas ambientales más importantes,y es resultado de las actividades del hombre.Las causas que originan esta contaminación son diversas,pero el mayor índice es provocado por las actividades industriales,comerciales,domesticas y agropecuarias. Los principales contaminantes del aire se clasifican en: PRIMARIOS Son los que permanecen en la atmósfera tal y como fueron emitidos por la fuente. Para fines de evaluación de la calidad del aire se consideran:óxidos de azufre, monóxido de carbono,óxido de nitrógeno, hidrocarburos y partículas. SECUNDARIOS Son los que han estado sujetos a cambios químicos,o bien,son el producto de la reacción de dos o más contaminantes primarios en la atmósfera.Entre ellos destacan oxidantes fotoquímicos yalgunos radicales de corta existencia como el ozono (O3). A nivel nacional, la contaminación atmosférica se limita a las zonas de alta densidad demográfica o industrial. Las emisiones anuales de contaminantes en el país son superiores a 16 millones de toneladas,el 65% es de origen vehiculaar. En la ciudad de México se genera 23.6% de dichas emisiones,en Guadalajara el 3.5%,y en Monterrey el 3%. Los otros centros industriales del país generan el 70% restante. PARTES POR MILLON (PPM) Para determinar la concentración de una substancia química en un volumen se utilizan las partes por millón de partes iguales.Cada millonésima parte de este volumen,correspondiente a la substancia de nuestro interés, se considera una parte por millón de la substancia. Las PPM se utilizan para determinar concentraciones muypequeñas de gases en la atmósfera. PARTES POR BILLON (PPB) Para determinar la concentración de substancia química en un volumen se utilizan las partes por billón.Se divide el volumen en un billón de partes iguales.Cada billonésima parte de este volumen,correspondiente a la substancia de nuestro interés,se considera una parte por billón de la substancia. Las PPM se utilizan para determinar concentraciones muypequeñas de gas es en la atmósfera. PARTICULAS SUSPENDIDAS EN SU FRACCION RESPIRABLE (PM-10) Criterios para evaluar la calidad del aire 150 ug/m³ (microgramos sobre metro cubico) en un promedio de 24 horas. Características del contaminante Partícula sólidas o líquidas dispersas en la atmósfera (su diámetro va de 0.3 a 10 um) como polvo, cenizas, hollín,partículas metálicas, cemento o polen.La fracción respirable de PST,conocida como PM-10, está constituida por aquellas partículas de diámetro es inferior a 10 micras,que tienen la particularidad de penetrar en el aparato respiratorio hasta los alvéolos pulmonares. Fuentes principales Combustión industrial ydoméstica del carbón,combustóleo y diesel; procesos industriales; incendios;erosión eólica y erupciones volcánicas. Efectos principales
- 43. o Salud:Irritación en la vías respiratorias;su acumulación en los pulmones origina enfermedades como silicosis y la asbestosis.Agravan el asma y las enfermedades cardiovasculares. Materiales:Deterioro en materiales de construcción yotras superficies. Vegetación: Interfieren en la fotosíntesis. Otros: Disminuyen la visibilidad yprovocan la formación de nubes. En general los principales contaminantes como:Monóxido de carbono,Ozono, Dióxido de Nitrógeno,Dióxido de Azufre, Hidrocarburos,plomo,y otros provocan demasiados problemas estos se miden en grados imecas lo cual se explicará después del cuadro de los contaminantes. Unidades Empleadas para el Monitoreo de la Calidad del Aire PARÁMETRO CLAVE UNIDAD RED Monóxido de Carbono CO PPM Dióxido de azufre SO2 PPM Dióxido de nitrógeno NO2 PPM MONITOREO AUTOMATICO Ozono O3 PPM Oxido de nitrógeno NOX PPM Acido sulfhídrico H2S PPM Partículas menores a 10 micras PM-10 ug/m³ Partículas suspendidas totalmente PST ug/m³ Plomo Pb ug/m³ Cobre Cu ug/m³ MONITOREO MANUAL Fierro Fe ug/m³ Cadmio Cd ug/m³ Níquel Ni ug/m³ Temperatura TMP °C Humedad Relativa RH % de Hum. Rel MONITOREO METEOROLOGICO Velocidad del viento WSP metros por segundo Dirección del viento WDR grados Indice Metropolitano de la Calidad del aire El índice de la calidad del aire,se define como un valor representativo de los niveles de contaminación atmosférica y sus efectos en la salud,dentro de una región determinada. El IMECA consta de algoritmos de cálculo fundamentales;el primero,para la obtención de subíndices correspondientes a diferentes indicadores de la calidad del aire;y el segundo,para la combinación de éstos en un índice global.
- 44. El primero involucrara la utilización de funciones segmentadas basadas en dos puntos de quiebra principales. Esos puntos fueron obtenidos a partir de los criterios mexicanos de la calidad del aire,asícomo de niveles para los que ocurren daños significativos a la salud.Al primero se le asigno el valor de 100 y al segundo de 500; entre estos dos puntos se definieron tres más,cuyo objetivo es clasificar el intervalo en diferentes términos descriptivos de la calidad del aire. La función principal del IMECA es mantener informada a la población sobre la calidad del aire en la Ciudad de México, asícomo observar el comportamiento de los distintos contaminantes ycomparar la calidad del aire entre zonas que utilicen índices similares. IMECA CALIDAD DEL AIRE EFECTOS 0-100 Satisfactoria. Situación favorable para la realización de todo tipo de actividades. 101-200 No Satisfactoria. Aumento de molestias en personas sensibles. 201-300 Mala Aumento de molestias e intolerancia relativa al ejercicio. 301-500 Muy Mala Aparición de diversos síntomas e intolerancia al ejercicio. IMECA Satisfactorio No Satisfactorio No Satisfactorio Malo 0-100 101-150 151-200 201-300 OXIGENO Y COMBUSTION Combustión es sinónimo de oxidación y, como ya se indicó consiste en la unión del oxigeno con la substancia combustible. Los combustibles pueden ser sólidos,líquidos o gaseosos: a. Sólidos:carbonos,lignitos,coques,maderas yresiduos combustibles de procesos de fabricación. b. Líquidos: alcohol,petróleo,sus derivados,y algunas veces breas. c. Gases: gas natural (el que sale de la tierra) y gases fabricados con obtenidos principalmente del carbón. La presencia del oxígeno (gas) pone de manifiesto su propiedad de comburencia.La combinación de este con otros elementos se llama oxidación. Cuando las oxidaciones son rápidas y generan en poco tiempo gran cantidad de energía calorifica y luminosa, se denominan combustiones.Para que la combustión se realice combustible sustancia que puede arder al combinarse rápidamente con el oxigeno dando como resultado luzy calor, y un comburente,el cual es un elemento o sustancia que al combinarse químicamente con otro,provoca la combustión de este. SEPARACION DE GASES EN UNA MEZCLA Una de las características de una mezcla es la de ser una unión aparente y que para comprobar este hecho podemos aplicar diferentes procedimientos de separación de mezclas . Leer más: http://www.monografias.com/trabajos/aire/aire.shtml#ixzz39NQ23XrH