LEYES-PONDERALES-ESTEQUIOMETRIA.ppt
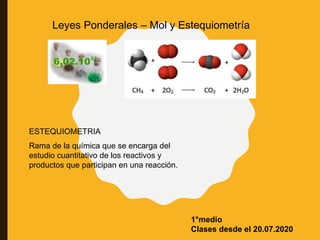
- 1. Rama de la química que se encarga del estudio cuantitativo de los reactivos y productos que participan en una reacción. ESTEQUIOMETRIA Leyes Ponderales – Mol y Estequiometría 1°medio Clases desde el 20.07.2020
- 2. Cambios en la Materia Cambios Físicos Cambios Químicos No afectan a la naturaleza de la sustancia SON SÓLO CAMBIOS DE ESTADO AFECTAN a la naturaleza de la sustancia
- 3. CAMBIOS FÍSICOS (Cambios de Estado) SÓLIDO LÍQUIDO GAS FUSIÓN EVAPORACIÓN CONDENSACIÓN SOLIDIFICACIÓN SUBLIMACIÓN PROGRESIVA SUBLIMACIÓN REGRESIVA Procesos Endotérmicos (Requieren energía) Procesos Exotérmicos (Liberan energía)
- 4. El cambio de estado: LÍQUIDO GAS ¿Cómo se llama? Por lo tanto si un líquido pasa a estado gas, se dice que éste se: El cambio de estado: SÓLIDO LÍQUIDO ¿Cómo se llama? Por lo tanto si un sólido pasa a estado líquido, se dice que éste se:
- 5. CAMBIOS QUÍMICOS: Afectan a la naturaleza de la sustancia REACCIÓN DE COMBUSTIÓN GAS NATURAL
- 6. MATERIA Sustancia Elemento Compuesto Mezcla Homogénea Heterogénea separación por métodos físicos separación por métodos químicos ALÓTROPO: distintas presentaciones de un elemento en un mismo estado de la materia CARBONO: Grafito – Diamante – Fulereno OXÍGENO: O2 – O3
- 7. LEYES DE ESTEQUIOMETRÍA LEY DE CONSERVACIÓN DE LA MATERIA (A. Lavoisier) La masa no se crea ni se destruye, sólo se transforma Ejemplo: H2 + Cl2 2 HCl LEY DE PROPORCIONES DEFINIDAS (L. Proust) Los elementos se combinan en proporciones definidas para formar un único compuesto Ejemplo: H2 + ½ O2 H2O H2 + O2 H2O2 LEY DE PROPORCIONES MÚLTIPLES (J. Dalton) Los elementos se combinan en distintas proporciones de números enteros y sencillos para generar distintos compuestos Ejemplo: C + ½ O2 CO C + O2 CO2
- 8. CONCEPTOS ESTEQUIOMÉTRICOS Átomo Elemento Compuest o Molécula ESTRUCTURA SUSTANCIA 2 o más, forman 2 o más, forman se presenta como se presenta como
- 9. ESTEQUIOMETRÍA : MOL O B J E T I V O : A P L I C A R E L M O L C O M O U N A H E R R A M I E N TA Q U E P E R M I T E C U A N T I F I C A R L A M AT E R I A .
- 11. ¿CÓMO CONTAMOS O AGRUPAMOS LOS ÁTOMOS? No puedo contar las moléculas !!! Esto nos puede servir !! Mundo Microscópico Mundo Macroscópic o
- 12. mol Montón o pila Átomos Moléculas Iones ¿QUÉ ES UN MOL? Cantidad de sustancia
- 13. ¿CÓMO DEFINIMOS MOL? • el mol es la cantidad de una sustancia que contiene tantas entidades elementales (átomos, moléculas u otras partículas) como átomos hay exactamente en 12 g (o 0.012 kg) del isótopo de carbono-12 1 mol Número de Avogadro
- 14. MOL: Mide cantidad… ¿qué cantidad? 6,023 x 1023 NA: número de Avogadro 6,02 x 1023 átomos 1 mol de átomos 6,02 x 1023 iones 1 mol de iones 6,02 x 1023 moléculas 1 mol de moléculas
- 15. LEY DE AVOGADRO
- 16. CONCEPTOS ESTEQUIOMÉTRICOS VOLUMEN MOLAR: Volumen que ocupa un mol de cualquier gas en C.N.P.T. 22,4 L C.N.P.T.: Condiciones Normales de Presión y Temperatura Presión : 1 atm (760 mmHg) Temperatura : 273 K (0°C) He O2 CO2 1 mol 1 mol 1 mol 1 atm 1 atm 1 atm 273 K 273 K 273 K 22,4 L 22,4 L 22,4 L
- 17. EQUIVALENCIAS 1 mol de carbono 1 mol de Azufre 1 mol de Mercurio 1 mol de cobre 1 mol de Hierro 12,01g de carbono 32,06g de Azufre 200,59g de Mercurio 64,54g de Cobre 55,93g de Hierro Mundo micro Mundo macro M O L RECUERDA PASAR SIEMPRE POR EL MOL.
- 18. MOL Ejemplos: 1 mol de He = 6,02 x 1023 átomos de He 1 mol de O2 = 6,02 x 1023 moléculas de O2 2 ● 6,02 x 1023 átomos de O 1 mol de CO2 = 6,02 x 1023 moléculas de CO2 6,02 x 1023 átomos de C 2 ● 6,02 x 1023 átomos de O 3 ● 6,02 x 1023 átomos en total
- 21. CONCEPTOS ESTEQUIOMÉTRICOS MASA ATÓMICA: Es la masa de un átomo medida en Unidades de Masa Atómica u.m.a. 1 u.m.a. = 1/12 m 12C El valor de Tabla Periódica indica la Masa Atómica Promedio (Se consideran los isótopos) Para efectos prácticos, usaremos el valor de Masa Atómica expresada en g/mol (Masa Molar Atómica)
- 22. CONCEPTOS ESTEQUIOMÉTRICOS MASA MOLAR (MM): Es la masa de un mol (átomos, moléculas, etc.) Su unidad de medida es: g/mol a) Calcular la masa molar de CaCO3 (Carbonato de Calcio) mCa = 40 g/mol mC = 12 g/mol mO = 16 g/mol MM CaCO3 = mCa + mC + 3 ● mO = (40 + 12 + 3 ● 16) g/mol = (40 + 12 + 48) g/mol = 100 g/mol
- 23. La Masa molecular es la suma de las masas atómicas de los átomos que componen la molécula la masa molar de un compuesto es numéricamente igual a su masa molecular en uma Uma g/mol Ejemplo: masa molecular del agua. 2(masa atómica del H) + masa atómica del O 2(1,008uma) +16,00 uma= 18.00 uma Masa moléculas del agua es 18,00 uma = masa molar 18,00g Por lo tanto: 18,00 g de agua contendrán 6,022x10^23 moléculas de agua.
- 24. A . H 2 SO 4 B. CA 3 (PO 4 )2 C. CUSO 4 X 5H 2 O E JERCICIOS DETERMINE L AS MASAS MOL ARES DE:
- 26. Análisis: MM CaCO3 = 100 g/mol En 100g de CaCO3 hay: 1 mol de moléculas de CaCO3 6,02 x 1023 moléculas de CaCO3 6,02 x 1023 átomos de Ca 6,02 x 1023 átomos de C 3 ● 6,02 x 1023 átomos de O 1 mol de átomos de Ca 1 mol de átomos de C 3 moles de átomos de O 1,5 moles de moléculas de O2
- 27. b) Calcular la MM de 147g de ácido sulfúrico que corresponden a 1,5 moles Utilizar: m n MM (mol)
- 28. Utilizando FACTORES DE CONVERSIÓN, desarrolle los siguientes problemas a. ¿Cuántos mol de hierro representan 25.0 g de hierro (Fe)? b. ¿Cuántos mol de magnesio están contenidos en 5.0 g de este metal? c. ¿Cuántos mol son 27 g de hidróxido de sodio (NaOH)? d. ¿Qué cantidad de sustancia (n) de hierro existe en 25 g de hierro puro (Fe)? e. ¿Cuál es la masa de 3,01x10^23 átomos de sodio (Na)?
- 29. j. ¿Cuántos átomos de oxígeno hay en: a) 0,25 mol de Ca(NO3)2 b) 1,50 moles de Na2CO3 k. El hidróxido de sodio (NaOH) es una sustancia que muchas dueñas de casa adquieren en ferreterías como soda cáustica y se utiliza para destapar cañerías. Si una señora compra 1 kg de dicha sustancia, a. ¿Cuántos moles de hidróxido de sodio adquirió? b. ¿Cuántas moléculas de hidróxido hay en un 1 kg? f. ¿Cuántos gramos son 3,01*10^24 átomos de Plomo? g. ¿Qué volumen ocupan en C.N.P.T 132g de CO2? h. ¿cuántas moléculas de glucosa (C6H12O6) existen en 900g de esa sustancia? i. ¿Cuántos átomos de cobre existen en 400g de alambre de ese material?