Estructura atomica.pptx
- 5. ESTRUCTURA ELECTRONICA DEL ATOMO La disposición de los electrones alrededor del núcleo de un átomo tiene como base la ocupación del estado o estados cuánticos discretos en los niveles de energía más bajo. (Mecánica Ondulatoria). Los electrones ocupan niveles de energía dispuestos discontinuamente en el interior del átomo. Cada electrón posee una energía característica. No puede haber más de dos electrones en cada átomo que contengan la misma energía. Existe una diferencia de energía bien definida entre cada electrón. Números Cuánticos Valores numéricos que representan la distribución de los electrones en un átomo en niveles de energía discretos. Existen un total de cuatro (4) números cuánticos: Número cuántico principal (n). Número cuántico secundario (l). Número cuántico magnético (ml). número cuántico de espín (ms).
- 6. ESTRUCTURA ELECTRONICA DEL ATOMO Número cuántico principal (n): Determina los estados cuánticos discretos permisibles para el electrón. Puede tomar valores enteros (1, 2, 3, 4, 5, 6, 7) y coincide con el mismo número cuántico introducido por Bohr . Está relacionado: Representa la capa cuántica a la que pertenece cada electrón. Con la distancia promedio del electrón al núcleo en un determinado orbital. Con el tamaño de este. Indica el nivel de energía al que pertenece cada electrón. A las capas cuánticas se le asigna un letra: Para n=1 …. La capa K Para n=2 …. La capa L Para n=3 …. La capa M Para n=4 …. La capa N Para n=5 …. La capa O Para n=6 …. La capa P Para n=7 …. La capa Q
- 7. ESTRUCTURA ELECTRONICA DEL ATOMO Número cuántico secundario (l). (NUMERO DE MEMENTO ANGULAR) Los niveles de energía, identificados con el número cuántico principal (n) , poseen subniveles, los cuales se asocian, además, a la forma del orbital, y son identificados por el número cuántico secundario (l). Los valores del número cuántico secundario dependen del número cuántico principal "n". Nos indica en que subnivel se encuentra el electrón. Toma valores desde 0 hasta (n - 1). La comunidad científica ha aceptado que los números que representan los subniveles (0, 1, 2, y 3) sean reemplazados por las letras s, p, d y f, respectivamente, para representar los distintos tipos de orbitales. (cada nivel de energía o capa tiene sus electrones repartidos en distintos subniveles) s para l:0 p para l:1 d para l:2 f para l:3
- 8. ESTRUCTURA ELECTRONICA DEL ATOMO Número Secundario(l) Si n = 1 (n – 1 = 0), entonces l = 0 (en el nivel de energía 1 no hay subniveles de energía, y para efectos de comprensión se considera este nivel 1 como subnivel 0) Si n = 2 (n -1 = 1), entonces l = 0, 1. El nivel de energía 2 posee dos subniveles, identificados como 0 y 1 Si n = 3 (n – 1 = 2), entonces l = 0, 1, 2. El nivel de energía 3 posee tres subniveles, identificados como 0, 1 y 2 Si n = 4 (n – 1 = 3), entonces l = 0, 1, 2, 3. El nivel de energía 4 posee cuatro subniveles, identificados como 0, 1, 2 y 3 Si n = 5 (n – 1 = 4), entonces l = 0, 1, 2, 3, 4. El nivel de energía 5 posee cinco subniveles, identificados como 0, 1, 2, 3 y 4
- 9. ESTRUCTURA ELECTRONICA DEL ATOMO Número cuántico magnético (ml): Indica el número de orbitales presentes en un subnivel determinado. Es decir los niveles de energía u orbitales para cada número cuántico acimutal. Puede tener todos los valores desde – l hasta + l pasando por cero. El número total de números cuánticos magnéticos para cada ml es: ml= 2l+1 Para n=1 .., (l=0) …, ml= 2(o)+1=1…, hay 1 números cuánticos magnéticos. Así que ml: 0… Por lo tanto tiene dos (2) electrones.
- 10. ESTRUCTURA ELECTRONICA DEL ATOMO Número Cuántico De Espín (ms) El Principio de exclusión de Pauli, establece que no puede haber más de dos electrones con giros propios opuestos en cada orbital. En las características de los espectros de emisión, se consideró que los electrones podían girar en torno a un eje propio, bien en el sentido de las agujas del reloj o en el sentido contrario. Para caracterizar esta doble posibilidad se introdujo el número cuántico de espín (ms) que toma los valores de + ½ o – ½.
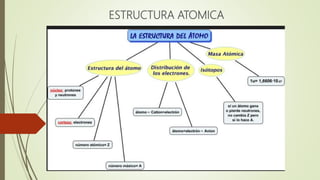
- 11. ESTRUCTURA ELECTRONICA DEL ATOMO LA DISTRIBUCIÓN DE NIVELES – SUBNIVELES - ORBITALES Y NÚMERO DE ELECTRONES, PARA LAS 4 PRIMERA CAPAS
- 12. FUERZAS INTERATOMICAS LAS FUERZAS INTERATOMICAS INTERMOLECULARES se definen como el conjunto de fuerzas atractivas y repulsivas que se producen entre las moléculas como consecuencia de la presencia o ausencia de electrones. Cuando dos o más átomos se unen mediante un enlace químico forman una molécula Los electrones que conforman la nueva molécula recorren y se concentran en la zona del átomo con mayor electronegatividad. La electronegatividad se define como la propiedad que tienen los átomos en atraer electrones. La concentración de electrones en una zona específica de la molécula crea una carga negativa, mientras mientras que la ausencia de los electrones crea una carga positiva. ENLACES PRIMARIOS. Los Enlaces primarios están asociados por lo general con la formación de moléculas. • Enlace iónico. • Covalente • Metálico • Los Enlaces secundarios se asocian generalmente con la atracción entre moléculas. • Enlace de Van der Waals
- 13. ENLACE QUIMICO Se denomina Enlace Químico a las uniones entre átomos que surgen al ceder, tomar o compartir electrones entre sí con el fin de lograr la estructura más estable en la última capa. Ley del Octeto Los átomos intercambiar electrones hasta completar ocho electrones en su último nivel de energía. Haciendo posible la unión química de los elementos.
- 14. ENLACE IONICO Generalmente se produce entre un elemento metálico (electropositivo) y elemento no metálico (electronegativo.
- 15. ENLACE IONICO Regla General. El enlace Iónico se produce entre un elemento muy electropositivo y uno elemento electronegativo.
- 16. CARACTERISTICAS DE LOS ENLACES IONICOS Su aspecto es cristalino y frágil. Elevado punto de fusión y ebullición Capacidad de conducir la corriente eléctrica. Función Principal del Enlace Ionico Es mantener unidos los átomos. Ocurre en la última capa de los electrones de un átomo.
- 17. EJEMPLOS DE ENLACES IÓNICOS Óxido de magnesio (MgO) Sulfato de cobre (CuSO4) Ioduro de potasio (KI) Hidróxido de zinc (Zn(OH)2) Cloruro de sodio (NaCl) Nitrato de plata (AgNO3) Fluoruro de litio (LiF) Cloruro de magnesio (MgCl2) Hidróxido de potasio (KOH) Nitrato de calcio (Ca(NO3)2) Fosfato de calcio (Ca3(PO4)2) Dicromato de potasio (K2Cr2O7) Fosfato disódico (Na2HPO4) Sulfuro de hierro (Fe2S3) Bromuro de potasio (KBr) Ácido sulfúrico (H2SO4) Carbonato de calcio (CaCO3) Hipoclorito de sodio (NaClO) Sulfato de potasio (K2SO4) Cloruro de manganeso (MnCl2)
- 18. ENLACE COVALENTE Se produce cuando dos o más átomos comparten electrones hasta completar su capa externa. Son estables, porque alcanzan una configuración de gas nobles al compartir electrones.
- 19. TIPOS DE ENLACE COVALENTE ENLACE COVALENTE SIMPLE: donde se comparte un par de electrón de valencia Ejemp: Fluoruro de Hidrogeno HF, es obtenido a través de un enlace covalente simple, donde se comparten dos átomos Tiene la misma C.E que es gas noble Helio con 2e- Tiene la misma C.E que es gas noble Neón con 8e- En el Diagrama de Lewis Se remplazan los 2e- Compartidos por una Línea Simple.
- 20. TIPOS DE ENLACE COVALENTE ENLACE COVALENTE DOBLE: Cuando dos átomos comparten dos pares de electrones Ejemp: Dioxido de carbono, es obtenido a través de un enlace covalente doble, donde se comparten dos electrones de valencia C: necesita 4e-, gas noble O: necesita 2e-, gas noble En el Diagrama Se reemplazan los 2e-por una Línea Simple. Obtiene: Átomo de C forme dos Enlaces Dobles con O con dos pares de e-
- 21. TIPOS DE ENLACE COVALENTE ENLACE COVALENTE TRIPLE: Se forma al compartir tres pares de electrones. Ejemp: Nitrógeno (N2)
- 23. ENLACE METÁLICO
- 25. APLICACIÓN
- 26. ENLACES SECUNDARIOS Las fuerzas de van der Waals, engloba colectivamente a las fuerzas de atracción entre las moléculas. Son fuerzas de atracción débiles que se establecen entre moléculas eléctricamente neutras (tanto polares como no polares), pero son muy numerosas y desempeñan un papel fundamental en multitud de procesos biológicos. Son fuerzas mas débiles que las internas que unen la molécula ya que dependen exclusivamente del tamaño y forma de la molécula pudiendo ser de atracción o de repulsión. Son tan débiles que no se las puede considerar un enlace, como el enlace covalente o iónico, solo se las considera una atracción Moléculas Polares: son aquellas cuyos enlaces son formados por átomos distintos con grandes diferencias de electronegatividad, formando moléculas polares. La molécula es eléctricamente neutra en su conjunto por tener igual de partículas positivas y negativas, pero no existe simetría en la distribución de la electricidad. La distribución de las cargas eléctricas no es simétrica respecto a un centro. Las moléculas están formadas por átomos diferentes y la carga eléctrica está más concentrada en una zona de la molécula que en otra. En este caso ocurre igual que en una pila, se forman polos eléctricos, con una pequeña carga negativa y otra positiva separadas, por eso se llaman polares.
- 27. ENLACES DE VAN DER WALLS NO polares: Son aquellas en las que no hay esa diferencia de zonas eléctricas positiva y negativa en la molécula- FUERZAS DE POLARIDAD (DIPOLO-DIPOLO) Cuando dos moléculas polares (dipolo) se aproximan, se produce una atracción entre el polo positivo de una de ellas y el negativo de la otra . Se forma entre un dipolo positivo de una molécula polar con el dipolo negativo de otra polar. Una atracción dipolo-dipolo es una interacción no covalente entre dos moléculas polares. Las moléculas que son dipolos se atraen entre sí cuando la región positiva de una está cerca de la región negativa de la otra. Podríamos decir que es similar al enlace iónico pero mucho más débil. Esta fuerza de atracción entre dos dipolos es tanto más intensa cuanto mayor es la polarización de dichas moléculas polares. Ejemplos: El sulfuro de hidrógeno H2S , el metanol CH3OH y la glucosa C6H12O6
- 28. ENLACES DE VAN DER WALLS FUERZAS DIPOLO INSTANTÁNEO-DIPOLO INDUCIDO Una molécula polar (dipolo), al estar próxima a otra no polar, induce en ésta un dipolo transitorio, produciendo una fuerza de atracción intermolecular llamada dipolo-dipolo inducido o interacción iónica. Son interacciones que ocurren a nivel de catión-anión, entre distintas moléculas cargadas, y que por lo mismo tenderán a formar una unión electrostática entre los extremos de cargas opuestas debido a la atracción entre ellas. Ejemplo: El agua cuya molécula es un dipolo, produce una pequeña polarización en la molécula no polar de oxígeno, la cual se transforma en un dipolo inducido.