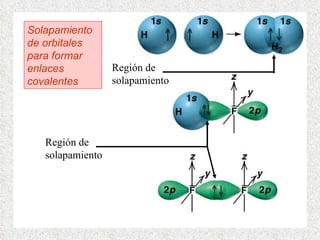
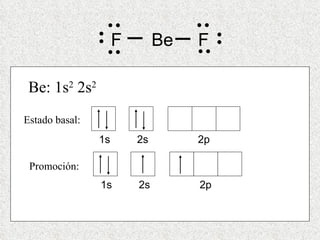
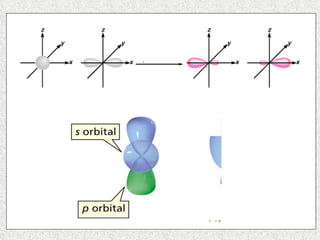
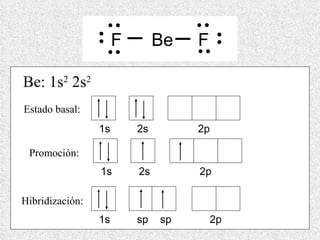
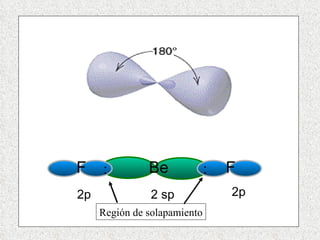
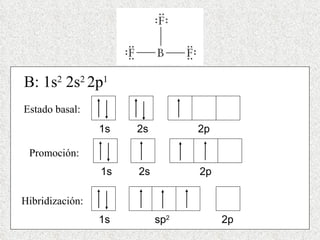
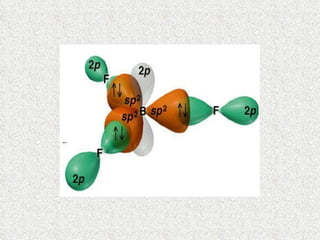
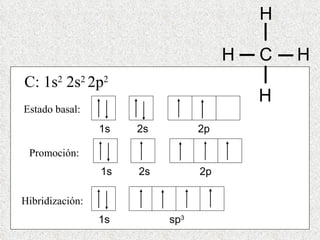
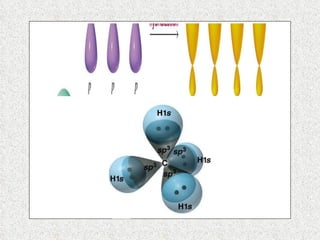
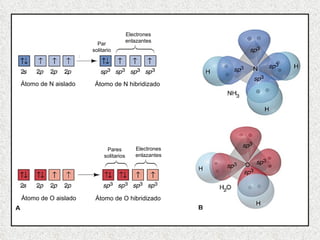
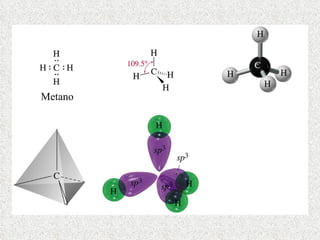
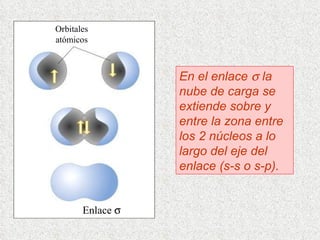
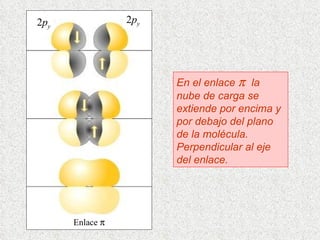
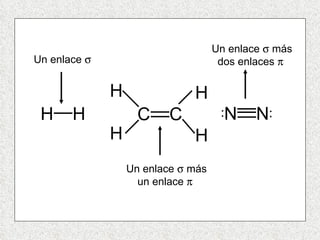
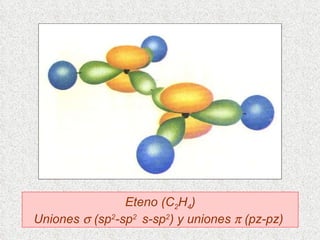
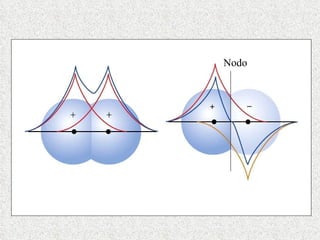
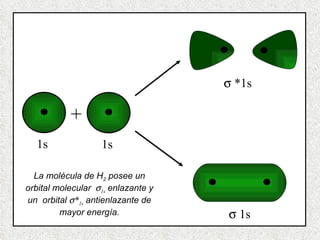
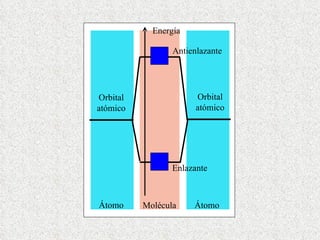
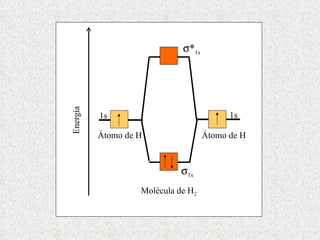
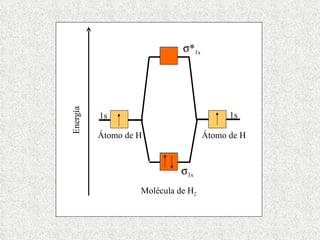
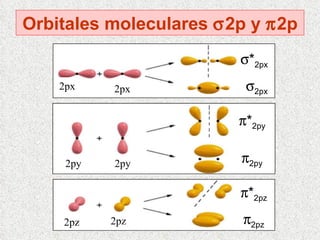
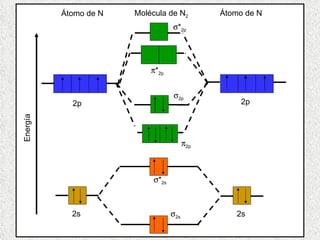
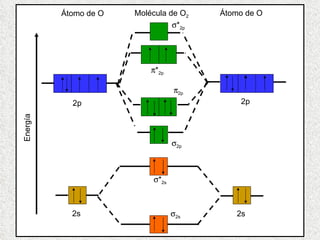
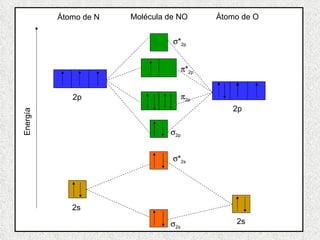
El documento resume tres teorías que explican la formación del enlace covalente: la teoría del enlace de valencia, que supone que los electrones ocupan orbitales atómicos individuales; la teoría de orbitales moleculares, que propone que los orbitales atómicos forman nuevos orbitales moleculares; y la teoría de repulsión de pares electrónicos de valencia. También describe los procesos de hibridación de orbitales y diferentes tipos de enlaces σ y π entre átomos.