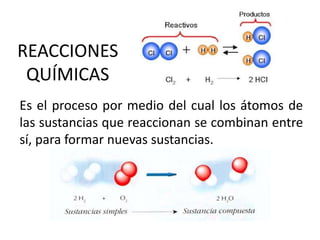
ReaccionesQuímicas
- 1. REACCIONES QUÍMICAS Es el proceso por medio del cual los átomos de las sustancias que reaccionan se combinan entre sí, para formar nuevas sustancias.
- 2. Ejemplo • Al quemar un pedazo de cinta de Magnesio se observa una luz brillante, por oxidación enérgica (violenta) del magnesio al combinarse con el oxígeno del aire. El resultado de ésta es el óxido de magnesio que es un polvo blanco. • 2Mg + O2 2MgO
- 3. CLASIFICACIÓN REACCIÓN DE COMBINACIÓN DIRECTA O SÍNTESIS • Es cuando dos o más elementos compuestos se combinan para formar un solo compuesto • 2Hg + O2 2HgO • CO2+H2O H2CO3 REACCIÓN DE DESCOMPOSICIÓN • Son cuando un compuesto se separa en 2 o más compuestos. • 2H2O 2H2+O2 • H2SO3 H2O+SO2 REACCIÓN DE SUSTITUCIÓN SIMPLE • Son cuando un elemento toma el lugar de otro, dentro de un compuesto • Zn+CuSO4 ZnSO4+Cu • Fe+2HCl FeCl2+H2
- 4. CLASIFICACIÓN REACCIÓN DE SUSTITUCIÓN DOBLE • Es cuando dos o radicales intercambian sus lugares dentro de un compuesto • AgNO3 + NaCl NaNO3+AgCl REACCIÓN DE NEUTRALIZACIÓN • Se da cuando reacciona un compuesto ácido con una base o hidróxido y se obtiene siempre como productos una sal mas agua. • ACIDO + BASE SAL + AGUA • HCl+NaOH---> NaCl +H2O
- 5. CLASIFICACIÓN REACCIÓN ÓXIDO -REDUCCIÓN • También conocidas como reacciones Redox, son aquellas en que los números de oxidación de ciertos elementos (generalmente 2) cambian al pasar de reactivos a productos. En una reacción redox siempre existirá un elemento que se oxide (pierda electrones) y otro que se reduzca (gane esos electrones); ambos procesos ocurren de forma simultanea. Para identificar una reacción redox debemos recordar las reglas para asdignar números de oxidación. • Oxidación: se refiere a la media reacción donde un átomo o un grupo de átomos pierden electrones. • Reducción: se refiere a la media reacción donde un átomo o un grupo de átomos ganan electrones. • Agente oxidante: es la sustancia que se reduce (gana electrones) provocando la oxidación. • Agente reductor: es la sustancia que se oxida (pierde electrones) provocando la reducción. • Son aquellas reacciones químicas en las cuales un átomo se oxida y otro se reduce. La cantidad de electrones perdidos (Átomos que se oxidan) es igual a la cantidad de electrones ganados (Átomos que se reducen). Para determinar cual es el átomo que se oxido y cual es el que se produce, se utiliza lo que se conoce como numero de oxidación.
- 6. NÚMERO DE OXIDACIÓN El número de oxidación es un número entero que representa el número de electrones que un átomo pone en juego cuando forma un compuesto determinado. El numero será positivo cuando tenga la capacidad de cederlos a otro átomo, de lo contrario será negativo es decir cuando gane electrones LAS REGLAS CONVENCIONALES PARA LA DETERMINACIÓN DEL NÚMERO DE OXIDACION 1.-El número de oxidación de un elemento libre es cero, ya sea monoatómica o poliatómica. Ejemplo Al0, Fe0, Cl2 0, l2 0. 2.-El número de oxidación de todos los elementos del 1A es +1. Ejemplo: Li+1, Na+1, K+1, etc. 3.-El número de oxidación de todos los elementos del grupo 2A es +2. ejemplo Be+2, Mg+2, Ca+2, Sr+2. 4.-El número de oxidación de los hidrógenos es +1, cuando forma compuestos, en los hidruros es –1. 5.-En el oxígeno el número de oxidación es –2, cuando forma compuestos y no en peróxidos que trabaja con –1 6.-Halógenos, formando sales: -1. F-1, Cl-1, K-1, I-1. Sumatoria del número de oxidación en una molécula es cero. +1 +4 -2 H2 C O3 +2 +4 -6= 0 Número de oxidación en un ión poliatómico es igual a la carga del ión. +5 -2 P O4 -3 +5 -8 = -3
