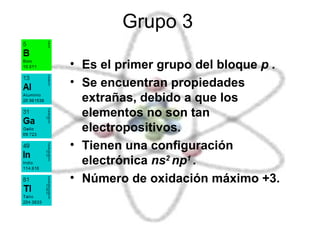
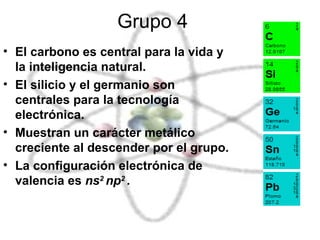
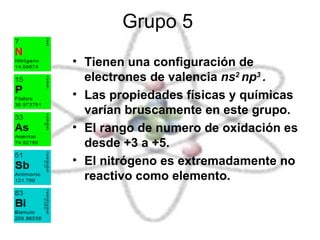
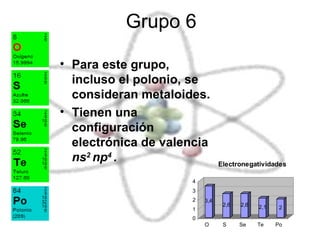
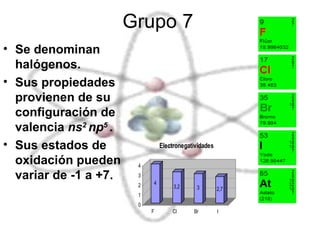
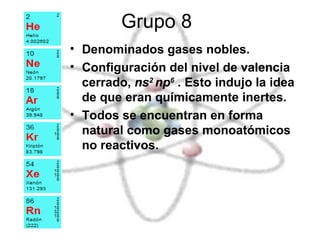
El documento describe las propiedades químicas de los elementos agrupados en la tabla periódica. Explica que el hidrógeno tiene los átomos más simples y es producido como subproducto de combustibles fósiles o electrolisis del agua. Los grupos 1 y 2 son metales alcalinos y alcalinotérreos respectivamente, muy reactivos. Los grupos 3 a 8, que incluyen carbono, nitrógeno, halógenos y gases nobles, tienen configuraciones electrónicas y propiedades distintivas dependiendo de su posición en la tabla




![Muchas Gracias [email_address]](https://image.slidesharecdn.com/powerpointelementosrepresentativo-danielamanfrini-110618172710-phpapp02/85/Elementos-representativo-11-320.jpg)