Diapositivas blogger 3 u 2
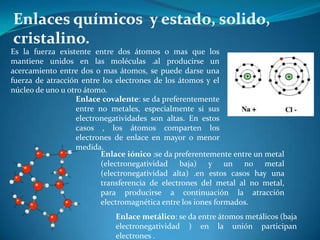
- 1. Enlaces químicos y estado, solido, cristalino. Es la fuerza existente entre dos átomos o mas que los mantiene unidos en las moléculas .al producirse un acercamiento entre dos o mas átomos, se puede darse una fuerza de atracción entre los electrones de los átomos y el núcleo de uno u otro átomo. Enlace covalente: se da preferentemente entre no metales, especialmente si sus electronegatividades son altas. En estos casos , los átomos comparten los electrones de enlace en mayor o menor medida. Enlace iónico :se da preferentemente entre un metal (electronegatividad baja) y un no metal (electronegatividad alta) .en estos casos hay una transferencia de electrones del metal al no metal, para producirse a continuación la atracción electromagnética entre los iones formados. Enlace metálico: se da entre átomos metálicos (baja electronegatividad ) en la unión participan electrones .
- 2. Clasificación de los sólidos por el tipo de enlace Sólidos iónicos: en este tipo de compuestos la red cristalina se forma por iones que se mantienen unidos por marcadas fuerzas electrostáticas. Estos iones tiene que ser positivos o negativos. Sólidos covalentes: estos se dividen en atómicos y moleculares. Atómicos: se unen entre si a través de enlaces normalmente covalentes . El enlace covalente se muy fuerte, poseen estructuras muy compactas, sus puntos de fusión y de ebullición son muy altos. Moleculares: las fuerzas mas pequeñas entre las partículas se encuentran en este tipo de sólidos. Están compuestas de moléculas que son relativamente inertes entre si . El acomodo de las moléculas en este tipo de cristales esta determinado por
- 3. Sólidos metálicos Sus átomos tienen electrones de valencia fácilmente desligables (potencial de ionización) y esto hace que todos los átomos metálicos formen iones positivos. En un trozo de metal, los meollos atómicos se mantienen unidos en un mar de electrones móviles. Empastes para diente
- 4. Estado solido cristalino Cuando los líquidos se enfrían suficientemente, se congelan y pasan al estado solido, se conoce como el punto de congelación de la sustancia. Las partículas de un solido, ya sean iones o moléculas, no están completamente rígidas, sino que son libres de vibrar dentro de uno s espacios definidos por lo tanto poseen una cierta energía cinética. Sólidos cristalinos: este tipo de solido presentan propiedades Sustancias amorfas: el vidrio y los físicas y químicas definidas y plásticos se incluyen dentro de los sólidos están en función de la por tener propiedades físicas muy constitución química. Sin parecidas a la de los sólidos, pero difieren embargo observamos que en su constitución interna. presentan puntos de fusión fijos y se rompen siempre a lo largo de
- 5. Conceptos de enlace quimico Estos enlaces químicos son fuerzas intramoleculares, que mantienen a los átomos unidos en las moléculas. En la visión simplista del enlace localizado, el número de electrones que participan en un enlace (o están localizados en un orbital enlazante), es típicamente un número par de dos, cuatro, o seis, respectivamente. Los números pares son comunes porque las moléculas suelen tener estados energéticos más bajos si los electrones están apareados. Teorías de enlace sustancialmente más avanzadas han mostrado que la fuerza de enlace no es siempre un número entero, dependiendo de la distribución de los electrones a cada átomo involucrado en un enlace. Por ejemplo, los átomos de carbono en el benceno están conectados a los vecinos inmediatos con una fuerza aproximada de 1.5, y los dos átomos en el óxido nítrico, NO, están conectados con aproximadamente 2.5. El enlace cuádruple también son bien conocidos. El tipo de enlace fuerte depende de la diferencia en electronegatividad y la distribución de los orbitales electrónicos disponibles a los átomos que se enlazan. A mayor diferencia en electronegatividad, con mayor fuerza será un electrón atraído a un átomo particular involucrado en el enlace, y más propiedades "iónicas" tendrá el enlace ("iónico" significa que los electrones del enlace están compartidos inequitativamente). A menor diferencia de electronegatividad, mayores propiedades covalentes (compartición completa) del enlace. Los átomos enlazados de esta forma tienen carga eléctrica neutra, por lo que el enlace se puede llamar no polar. Los enlaces covalentes pueden ser simples cuando se comparte un solo par de electrones, dobles al compartir dos pares de electrones, triples cuando comparten tres tipos de electrones, o cuádruples cuando comparten cuatro tipos de electrones.
- 6. Clasificación: Enlace covalente: Se da preferentemente entre no metales, especialmente si sus electronegatividades son altas. En estos casos, los átomos comparten los electrones de enlace en mayor o menor medida. Enlace iónico: Se da preferentemente entre un metal (electronegatividad baja) y un no metal (electronegatividad alta). en estos casos hay una transferencia de electrones del metal al no metal, para producirse a continuación la atracción electromagnética entre los iones formados. Enlace metálico: Se da entre átomos metálicos (baja electronegatividad), en la unión participan electrones deslocalizados por la red metálica.
- 7. Simbolos lewis y regla del octeto La estructura de Lewis, también llamada diagrama de punto, modelo de Lewis o representación de Lewis, es una representación gráfica que muestra los enlaces entre los átomos de una molécula y los pares de electrones solitarios que puedan existir. Esta representación se usa para saber la cantidad de electrones de valencia de un elemento que interactúan con otros o entre su misma especie, formando enlaces ya sea simples, dobles, o triples y estos se encuentran íntimamente en relación con los enlaces químicos entre las moléculas y su geometría molecular, y la distancia que hay entre cada enlace formado.
- 8. La regla del octeto, establece que los átomos se enlazan unos a otros en el intento de completar su capa de valencia (última capa de la electrosfera). La denominación “regla del octeto” surgió en razón de la cantidad establecida de electrones para la estabilidad de un elemento, o sea, el átomo queda estable cuando presenta en su capa de valencia 8 electrones. Para alcanzar tal estabilidad sugerida por la regla del octeto, cada elemento precisa ganar o perder (compartir) electrones en los enlaces químicos, de esa forma ellos adquieren ocho electrones en la capa de valencia. Veamos que los átomos de oxígeno se enlazan para alcanzar la estabilidad sugerida por la regla del octeto. La justificativa para esta regla es que las moléculas o iones, tienden a ser más estables cuando la capa de electrones externa de cada uno de sus átomos está llena con ocho electrones (configuración de un gas noble). Es por ello que los elementos tienden siempre a formar enlaces en la búsqueda de tal estabilidad.
- 9. En una solución, los enlaces iónicos pueden romperse y se considera entonces que los iones están disociados. Es por eso que una solución fisiológica de cloruro de sodio y agua se marca como: Na+ + Cl-, mientras que los cristales de cloruro de sodio se marcan: Na+Cl- o simplemente NaCl.
- 10. ENLACE DEL CLORURO SODICO
- 11. CARACTERISTICAS DE ESTE ENLACE Ruptura de núcleo masivo. Son sólidos de estructura cristalina en el sistema cúbico. Altos puntos de fusión (entre 300 °C o 1000 °C)2 y ebullición. Son enlaces resultantes de la interacción entre los metales de los grupos I y II y los no metales de los grupos VI y VII. Son solubles en agua y otras disoluciones acuosas. Una vez en solución acuosa, son excelentes conductores de electricidad. En estado sólido no conducen la electricidad. Si utilizamos un bloque de sal como parte de un circuito en lugar del cable, el circuito no funcionará. Así tampoco funcionará una bombilla si utilizamos como parte de un circuito un cubo de agua, pero si disolvemos sal en abundancia en dicho cubo, la bombilla del circuito se encenderá. Esto se debe a que los iones disueltos de la sal son capaces de acudir al polo opuesto (a su signo) de la pila del circuito y por ello éste funciona.
- 12. Elementos que forman el enlace iónico El elemento metálico se convierte en ión positivo (catión) El elemento no metálico se convierte en ión negativo (anión) Na(g) Na++ e X (electronegatividad) =0,9Cl 0,9Cl(g) + e Cl- X (electronegatividad) =3,9Na+ Na+ +Cl NaCl(g) [Ne]3s2p5 [Ne]3s1 [Ne] [Ne]3s2p6
- 13. PROPIEDADES DE LOS COMPUESTOS IÓNICOS Un compuesto iónico es un compuesto químico formado por dos sustancias con una diferencia significativa en sus electronegatividades. •Las sustancias iónicas se encuentran en la naturaleza formando redes cristalinas, por tanto son sólidas. •Su dureza es bastante grande, y tienen por lo tanto puntos de fusión y ebullición altos.
- 14. PROPIEDADES FÍSICAS PROPIEDADES FÍSICAS DE LOS COMPUESTOS Son sólidos con elevados puntos de fusión. Son solubles en disolventes polares (agua). Sin embargo, presentan baja solubilidad en disolventes apolares. Fundidos y en disolución acuosa conducen la corriente eléctrica. Se obtienen a partir de elementos con distinta electronegatividad (metal y no metal)
- 15. INTEGRANTES: EQUIPO 3 -ANABEL SUAZO MUÑOZ -JOSE FERNANDO MARTINEZ AGUILERA -MISAEL JIMENEZ GARCIA -EDUARDO MARTAGON -JAVIER ANTONIO SALINAS COBARRUBIAS -JUAN EMMANUEL IPARREA RODRIGUEZ